Esimerkki kemiallisista alkuaineista
Kemia / / July 04, 2021
Kemiallinen alkuaine se on puhdas aine, joka koostuu samantyyppisistä atomeista, puolestaan muodostunut useita protoneja ja neutroneja ytimessä, ja määrä elektronit kiertoradoillaan. Jotkut löydetään luonnollisesti, toiset muodostamalla yhdisteen molekyylit, ja toiset on luotu suorittamalla laboratoriomenettelyjä. Kaikki kemialliset alkuaineet muodostavat koko maailmankaikkeuden aineen ja ylläpitävät ihmiskehon olemassaoloa ja toimintaa.
Jokaisella elementillä on ominaisuuksia ja käyttäytymistä, jotka tekevät siitä eron ja tekevät siitä ainutlaatuisen, mutta samalla se esittelee yhtäläisyyksiä ryhmässä elementtejä ilmentymässä, joka heillä on maailmankaikkeus. Tästä syystä on olemassa kemiallisten alkuaineiden jaksollinen taulukko, joka käsittelee näitä yhtäläisyyksiä elementtien yhtenäiseksi ryhmittelemiseksi ja helpottaa niiden ominaisuuksien tutkimista.
Elementin atominumero
Atomi kantaa ytimessä useita protoneja, joita seuraa sama määrä neutroneja. Tähän numeroon sitä kutsutaan atomiluvuksi
, edustettuna Z akateemisiin tarkoituksiin ja kirjallisuudessa. Jokaiselle elementille tämä numero on yksilöllinen. Ei ole kahta elementtiä, joilla on sama atominumero. Jaksollisessa taulukossa keskitytään myös tähän kriteeriin niiden tilaamiseksi.Elementin symboli
Alkemian aikoina, jotka ulottuvat noin vuoteen 400-1000 jKr. C., alkemistit tallensivat kokeilunsa osoittamalla symboleja elementeille. Ne olivat yksinkertaisia symboleja, jotka oli tehty geometrisilla kuvioilla, edustamaan yksittäistä elementtiä ja tutkittuja muunnoksia.
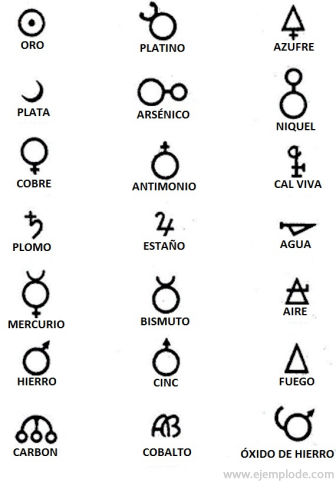
Joitakin esimerkkejä alkeemisista symboleista ja niiden edustaman elementin tai yhdisteen nimi.
Nykyaikaisen kemian aikakaudella elementit on edelleen esitetty symboleilla, tässä tapauksessa kirjaimilla, jotka viittaavat niiden nimiin latinaksi tai englanniksi.
Esimerkiksi:
Natriumin symboli on Na, latinankielisellä nimellä Natrium
Kulta symboli on Au, latinankielisellä nimellä Aurum
Hopean symboli on Ag, latinankielisellä nimellä Argentum
Kuparin symboli on Cu, latinankielisellä nimellä Cuprum
Antimonin symboli on Sb, latinankielisellä nimellä Stibium
Raudan symboli on Usko, latinankielisellä nimellä Ferrum
Elohopean symboli on Hg, latinankielisellä nimellä Hydrargyrum, mikä tarkoittaa "nestemäistä hopeaa"
Kaliumin symboli on K, latinankielisellä nimellä Kalium
Kemiallisten elementtien ryhmät:
Kemiallisten alkuaineiden jaksollinen taulukko luokittelee nämä ryhmien mukaan: ryhmät A ja ryhmät B. Ryhmät A ovat kahdeksan, jotka sisältävät Elementit Emäksinen, Alkalinen-maanläheinen, Terreos, kolme Elements-perhettä, joiden pää määrittelee perheen nimen: Hiiliperhe, Typpiperhe, Rikkiperhe, Halogeenit ja jalokaasut. Ryhmät B muodostuvat kaikista ryhmistä Siirtymämetallit ja Harvinaiset maapallot, jotka ovat myös kaksi suurta perhettä: Lantanidit Y Aktinidit.
Ryhmä IA: emäksiset alkuaineet:
Alkalisten alkuaineiden sarja koostuu vedystä (H), litiumista (Li), natriumista (Na), kaliumista (K), rubidiumista (Rb), cesiumista (Cs) ja frangista (Fr). Heillä kaikilla on elektroninen kokoonpano siten, että viimeisessä kuoressa heillä on elektroni. Heidän nimensä johtuu siitä, että joutuessaan kosketuksiin veden kanssa ne reagoivat muodostamaan emäksiä tai hydroksideja. Se on yleinen käyttäytyminen näiden elementtien välillä. Mitä suurempi elementin atomi, sitä reaktiivisempi se on, koska voimalla, jolla ydin säilyttää elektronin viimeisestä kuoresta, on yhä vähemmän ulottuvuutta. Ne pystyvät muodostamaan ionisidoksia halogeenien kanssa. Esimerkiksi: Ionisidos, jolla on runsaasti läsnäoloa, on natrium-kloori, joka muodostaa natriumkloridia NaCl.
Ryhmä IIA: maa-alkalielementit:
Nämä alkuaineet ovat: beryllium (Be), magnesium (Mg), kalsium (Ca), strontium (Sr), barium (Ba) ja radium (Ra). Ne eivät ole luonteeltaan vapaita; toisaalta sen karbonaatteja ja silikaatteja on suhteellisen runsaasti. Ne ovat argentiinalaisia valkoisia ja kiteisiä. Ne yhdistyvät helposti hapen kanssa, jos ne altistuvat ilmalle. Tämä johtuu osittain siitä, että heidän viimeisessä kuoressaan on kaksi elektronia, mikä vastaa hapen vastaanottokapasiteettia. Barium on ryhmän aktiivisin alkuaine, ja yhdessä kalsiumin kanssa heillä on eniten teollisia sovelluksia ryhmässä.
Ryhmä IIIA: Maan elementit:
Ryhmä IIIA sisältää alkuaineet boori (B), alumiini (Al), gallium (Ga), indium (In) ja tallium (Tl). Boori on ei-metallinen alkuaine, Alumiini on amfoteerinen (amfrotroottinen), toisin sanoen se kykenee toimimaan happona ja emäksenä; ja muut kolme ovat metallisia elementtejä. Heidän viimeisessä kuoressaan on kolme elektronia, jotka tuottavat valenssin +3, vaikka joskus gallium toimii +1 ja +2 valenssilla joissakin yhdisteissä. Boori on ainoa elementti tässä sarjassa, joka muodostaa hydridejä. Boori ja alumiini muodostavat karbideja.
Ryhmä IVA: Hiiliperhe:
Ryhmän IVA edustavat elementit ovat hiili (C), pii (Si), germanium (Ge), tina (Sn) ja lyijy (Pb). Kaksi ensimmäistä ovat ominaisuuksiltaan pohjimmiltaan ei-metallisia, mutta Germanium, Tina ja Lyijy ovat metallisia, ja mitä enemmän, sitä suurempi on niiden atomiluku. Piiä lukuun ottamatta jokaisen elementin valenssit ovat +4 ja +2.
Hiili ja pii muodostavat yhdisteitä, joissa alkuaineiden atomit yhdistyvät jaettujen elektronien parilla. Hiili on orgaanisten yhdisteiden ydin yhdistämällä vety, happi, typpi, rikki ja joskus pii.
Piin ja germaniumia käytetään elektronisten komponenttien valmistukseen, koska niillä on ominaisuus toimia puolijohteiden tavoin.
Ryhmä VA: Typpiperhe:
Ryhmä VA sisältää alkuaineet typpi (N), fosfori (P), arseeni (As), antimoni (Sb) ja vismutti (Bi). Typpi ja fosfori ovat ei-metallisia, arseeni ja antimoni ovat metalloideja, ja vismutti on metalli. Näille alkuaineille on tunnusomaista hydridien muodostaminen, joista vähiten myrkyllinen on ammoniakki NH3. Typpi muodostaa typpihapon HNO: n3, mukana suolahapon kanssa Agua Regiassa, seos, joka kykenee liuottamaan jalometalleja, kuten kultaa ja hopeaa.
Typpi on mukana myös kahdessa suuressa orgaanisten yhdisteiden ryhmässä, joita kutsutaan amiineiksi ja amideiksi, joita voidaan pitää ammoniakki NH: n johdannaisina.3, korvaamalla vety hiilivetyketjulla.
Ryhmä VIA: Happiperhe:
Koostuu hapen (O), rikin (S), seleenin (Se), telluurin (Te) ja poloniumin (Po) alkuaineista. Happi on aktiivisinta, ja sillä on kyky muodostaa helposti kovalenttisia sidoksia. Kosketuksessa metallien kanssa kosteissa olosuhteissa se muodostaa oksideja. Se muodostaa resonanssimolekyylin nimeltä otsoni, joka suojaa planeettaa UV-säteilyltä.
Ryhmä VIIA: Halogeenit:
Sen nimi tarkoittaa "Sales Formers". Ryhmä koostuu alkuaineista Fluori (F), Kloori (Cl), Bromi (Br), Jodi (I) ja Astate (At). Heillä on seitsemän elektronia viimeisessä kuoressa, mikä sallii niiden olevan yhden elektronin reseptorit. Tämä laatu saa ne kytkeytymään ryhmän IA alkuaineisiin muodostaen binäärisiä suoloja. Fluorille on tunnusomaista, että sillä on koko jaksollisen järjestelmän suurin elektronegatiivisuus, jonka arvo on 4,0, sen vastineena on Cesium, elektronegatiivisuudella 0,7. Tämän ominaisuuden avulla sillä on voimaa houkutella muita atomeja ja asettaa etusijalle sidoksen muodostaminen niiden kanssa ne.
Ryhmä VIIIA: Jalokaasut:
Sitä kutsutaan myös inerttien kaasujen ryhmäksi, ja se koostuu alkuaineista Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) ja Radon (Ra). Ne ovat elementtejä, joilla on täydellinen elektroninen kokoonpano, joten ne eivät pysty reagoimaan tavallisissa olosuhteissa. Niitä käytetään pääasiassa valaiseviin liikennemerkkeihin, jotka lähettävät näkyvää valoa, kun niihin tapahtuu sähkövirta.
Ryhmät B: Siirtymämetallit:
Kymmenessä kolmen elementin ryhmässä siirtymämetallit on ryhmitelty. Näihin kuuluvat parhaat sähköjohtimet: hopea (Ag), kupari (Cu), kulta (Au); parhaat rakennuskomponentit kaupunkien rakentamiseen ja suunnitteluun Rauta (Fe), titaani (Ti), alumiini (Al), zirkonium (Zr), volframi (W); parhaat katalyyttikomponentit: nikkeli (Ni), vanadium (V), platina (Pt); ja päällysteen pääaineosat: kadmium (Cd), kromi (Cr), sinkki (Zn). Ne käsittelevät yleensä valensseja välillä +1 ja +3, mutta kromin kaltaiset elementit käsittelevät valensseja +2, +3, +6.
Harvinaiset maametallit: Lantanidit ja aktinidit:
Niitä kutsutaan harvinaisiksi maapalloksi niiden niukkuuden vuoksi planeetalla. Ne koostuvat kahdesta ryhmästä: Lanthanides ja Actinides. Ne löytyvät jaksollisen järjestelmän kahdesta erillisestä rivistä. Ne toimivat yleensä valenssilla +3 ja muodostavat yleensä hydroksideja. Tärkein osa niistä on cerium, jota käytetään pyroforisten seosten valmistuksessa (Alloy Mischmetal, sytyttimien kiville), valaistuskaasuletkuissa ja ultraviolettisäteitä ja lämpösäteilyä absorboivien erityisten lasien valmistuksessa.
Tehokkaimmat radioaktiiviset elementit, kuten uraani (U) ja plutonium (Pu), ovat osa näitä ryhmiä. jotka epävakaudensa vuoksi vapauttavat energiaa ja hajoavat menettämällä alfa - partikkeleita ( Helium). Myöhemmin niistä tulee vähemmän epävakaita elementtejä radioaktiivisen sarjan mukaan.


