20 exemples de phénomènes chimiques
Divers / / July 04, 2021
Les phénomènes chimiques (ou alors réactions chimiques) sont ces phénomènes dans lesquels des changements se produisent dans la matière, et de nouvelles substances appelées "produits" sont formées, et d'autres appelées "réactifs" se décomposent. Par exemple: pourriture du bois, combustion du papier, compostage.
Les réactions chimiques peuvent être spontané (réactions qui se produisent sans besoin d'énergie ou de catalyseurs) ou pas spontané (réactions qui nécessitent l'apport d'énergie, de catalyseurs ou d'une intervention extérieure pour se produire). Plusieurs fois, pour qu'une réaction se produise, il est nécessaire que les réactifs aient une Température spécifique, un pH une valeur de pression définie, etc.
Il peut également être essentiel de contrôler la rapidité auxquels se produisent des réactions chimiques. Les catalyseurs Ce sont des substances qui sont ajoutées à une réaction chimique pour augmenter sa vitesse, tandis que les inhibiteurs sont des substances qui ralentissent la vitesse des réactions chimiques. D'autres facteurs qui affectent la vitesse d'une réaction chimique sont la température, la pression, la concentration des réactifs et la nature de la réaction elle-même.
Il peut vous servir :
Types de phénomènes chimiques
Les réactions chimiques peuvent être :
Réactions inorganiques. Intervenir composés inorganiques et peut être classé selon :
- Sens dans lequel la réaction se produit.
-
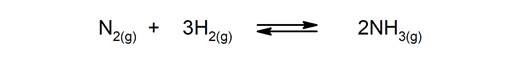
Réactions réversibles. Ils se produisent dans les deux sens, de sorte que les produits peuvent se décomposer et former à nouveau les réactifs.
-
Réactions irréversibles. Ils ne se produisent que dans un sens.

-
Réactions réversibles. Ils se produisent dans les deux sens, de sorte que les produits peuvent se décomposer et former à nouveau les réactifs.
- Le type de particule qui réagit.
-
Réactions acido-basiques. Le transfert d'ions H se produit+.

-
Réactions d'oxydo-réduction. Un des réactifs s'oxyde (augmente son nombre de oxydation), tandis que l'autre est réduit (son indice d'oxydation diminue). Dans ces réactions, un transfert d'électrons se produit.

-
Réactions acido-basiques. Le transfert d'ions H se produit+.
- La vitesse de réaction.
-
Réactions rapides. Ils surviennent en très peu de temps.
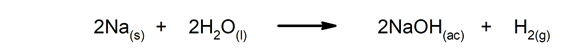
-
Des réactions lentes Ils mettent beaucoup de temps à se terminer.
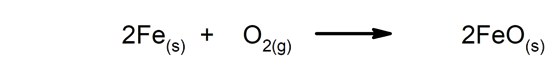
-
Réactions rapides. Ils surviennent en très peu de temps.
- La forme de l'énergie qu'il émet ou absorbe.
-
Réactions exothermiques. Au fur et à mesure qu'ils se produisent, ils dégagent de la chaleur.
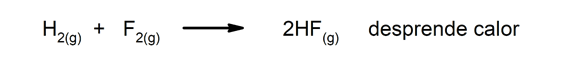
-
Réactions endothermiques. Lorsqu'elles se produisent, elles absorbent de la chaleur.

-
Réactions exolumineuses. Lorsqu'elles se produisent, elles émettent de la lumière.

-
Réactions endolumineuses. Pour arriver, ils ont besoin de lumière.

-
Réactions exothermiques. Au fur et à mesure qu'ils se produisent, ils dégagent de la chaleur.
- Le type de transformation.
-
Réactions de synthèse ou d'addition. Deux substances se combinent pour former une nouvelle substance.
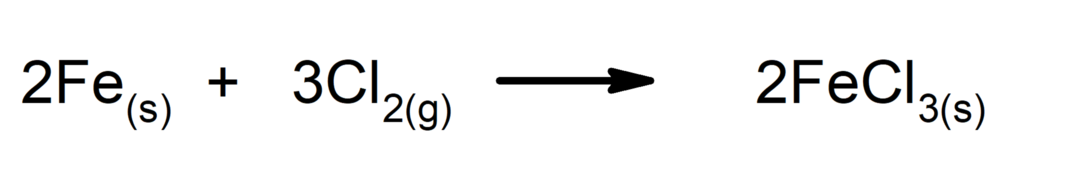
-
Réactions de décomposition. Une ou plusieurs substances se décomposent en leurs constituants les plus simples.
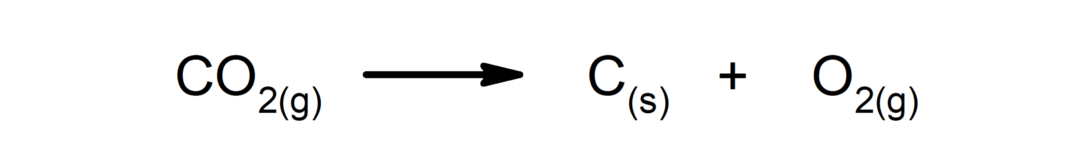
-
Réactions de déplacement ou de substitution. Un élément ou un composé en remplace un autre dans un composé, le libérant.
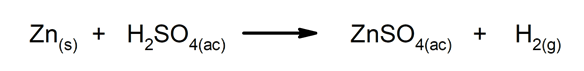
-
Réactions de double substitution. Deux composés échangent des éléments ou des composés en même temps.

-
Réactions de synthèse ou d'addition. Deux substances se combinent pour former une nouvelle substance.
Réactions organiques. Ce sont des réactions dans lesquelles interviennent des composés organiques. Ils ont de nombreuses classifications basées sur le type de composé organique qui réagit et le type de réaction qu'il subit. Quelques exemples sont:
-
Halogénation des alcanes. Un hydrogène d'un hydrocarbure par un halogène.
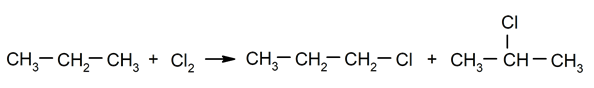
-
Combustion d'alcanes. Un alcane réagit avec l'oxygène pour générer du dioxyde de carbone et de l'eau, si la combustion est complète.
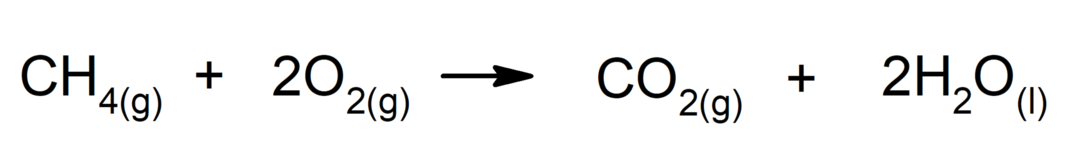
-
Halogénation de alcènes. Un ou les deux hydrogènes des carbones impliqués dans la double liaison sont remplacés par des halogènes.
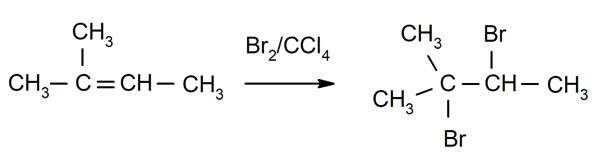
-
Hydrogénation des alcènes. Des hydrogènes sont ajoutés aux carbones impliqués dans la double liaison pour former l'alcane correspondant.
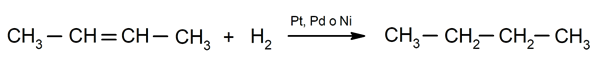
Importance des phénomènes chimiques
De nombreux phénomènes chimiques maintenir la vie des êtres vivants, comme la digestion chez l'homme et les animaux, la photosynthèse chez les plantes et la respiration chez les deux.
Un autre processus chimique très important, en particulier dans la vie de micro-organismes, est le fermentation, qui est habituellement utilisé dans la fabrication de aliments comme les fromages, les yaourts, les vins et les bières.
Tout le augmenter et le croissance d'un être en vie Il implique des réactions chimiques qui s'y déroulent, parfois stimulées par certaines conditions environnementales.
Exemples de phénomènes chimiques
Autour de nous, il existe de nombreux cas de phénomènes ou de processus chimiques qui les incluent :
- Pourriture du bois
- La combustion Papier
- Résistance à antibiotiques bactéries
- Lait qui tourne au vinaigre
- Désinfecter une plaie avec de l'alcool
- Utiliser du sel de fruits pour lutter contre les brûlures d'estomac
- Brûler une bougie
- La coagulation du sang
- Fatigue musculaire après un exercice intense
- La mort de insectes par des insecticides
- Obtention du roquefort
- Obtention du cidre
- Obtenir du yaourt
- Compostage
- Ensilage
- Obtention de bioéthanol à partir de mélasse
- Des boîtes de conserve gonflées
- Œuf pourri
- Rouille d'une grille
- Obtention de biodiesel à partir d'huile de palme
Phénomènes chimiques dans l'industrie
Certains phénomènes chimiques sont également déterminants dans laindustrie. Pour commencer, la combustion de hydrocarbures (comme l'essence, le diesel ou le kérosène) produit énergie pour faire fonctionner les machines qui gèrent d'innombrables processus industriels.
D'autre part, le industrie sidérurgique, papier, plastiques, matériaux de construction, peintures, médicaments, produits pour le agro, etc., reposent sur divers phénomènes chimiques tels que la galvanisation, l'électrolyse et de nombreux d'autres plus.
La génération de nouvelles sources d'énergie (comme le biodiesel et le bioéthanol) repose également sur ce type de phénomène.
La transformation de l'énergie
Dans les phénomènes chimiques, il est courant qu'il y ait transformation de l'énergie. Par exemple, lorsque l'énergie chimique contenue dans les liaisons d'une certaine molécule est transformée en énergie électrique ou libérée sous forme de chaleur (cela se produit dans les phénomènes exothermiques, comme lorsque l'acide chlorhydrique est mélangé avec du zinc), il y a une transformation de énergie. La même chose se produit lorsque l'énergie lumineuse est captée et transformée en énergie chimique.
Certains processus chimiques nécessitent de la chaleur pour fonctionner et sont appelés « endothermiques ». D'autres nécessitent la présence de catalyseurs ou de cofacteurs.