Exemple de molécules organiques et inorganiques
Chimie / / November 13, 2021
La Chimie générale c'est la science qui étudie tous les types de matière qui existent, et ses changements internes avoir des contacts entre différents types de ceci.
La Chimie organique C'est la partie de la chimie générale destinée à étudier la matière dont le constituant principal est le Élément carbone, et que il fait partie des organismes vivants.
La Chimie inorganique C'est la partie de la chimie générale qui est chargée d'étudier ce que l'on appelle "matière minérale", qui fait partie du je ne vis pas environnement.
La Molécule est l'union de divers atomes de différents éléments chimiques pour former de nouvelles substances, avec leurs propriétés particulières.
En chimie générale, Éléments ce sont les substances pures qui sont formés par atomes d'un seul type. Les éléments sont classés dans le tableau périodique des éléments chimiques.
Juste comme lui L'atome est l'unité fondamentale des éléments, la La molécule est l'unité principale des composés, qui sont des substances qui ont un comportement chimique caractéristique.
Les Composés peut se former à la suite de phénomènes naturels, ou alors être créé dans les laboratoires ou en Installations industrielles, donc les molécules sont présentes partout. Les molécules se trouvent dans les minéraux, dans les feuilles des arbres, dans les aliments, dans les médicaments, dans l'eau que nous buvons, dans l'air que nous respirons et même dans la pollution de l'environnement.
La chimie générale est principalement divisée en Chimie inorganique Oui Chimiqueà OrganisationmI CA, de sorte que les molécules peuvent également être classées en inorganiques et organiques.
Molécules inorganiques
En chimie inorganique, les molécules sont principalement formées par le combinaison d'atomes de valences positives avec d'autres de valences négatives, dans des liaisons ioniques. Ces liaisons sont formées principalement par les forces électromagnétiques entre les atomes, générées par la présence d'électrons de valence.
Ainsi, tous les composés ioniques apparaissent, tels que les sels, les sels oxygénés, les acides, les acides oxygénés, les oxydes et les hydroxydes.
Molécules inorganiques comme électrolytes
La principale propriété des molécules ioniques est que lorsqu'elles entrent en contact avec l'eau H2OU ALORS, ils sont séparés en ses deux parties: positive et négative. Ces deux parties, atomes ou groupes d'atomes chargés électriquement, sont dispersées dans l'eau. A la substance inorganique capable de se séparer ainsi dans l'eau, il s'appelle électrolyte.
La solution formée par l'eau et les particules chargées positivement et négativement est appelée "Solution électrolytique". Ce type de solution a la capacité de conduire des courants électriques, c'est pourquoi il est utilisé dans les cellules électrochimiques, telles que les batteries de voiture.
Acides inorganiques et molécules alcalines
Dans le cas de molécules inorganiques telles que Acides, Les Oxyacides et les Hydroxydes, en même temps qu'ils se séparent en une partie positive et négative, ils contribuent à la Solution une propriété appelée Potentiel Hydrogène, mesuré comme le logarithme négatif de la concentration en ions hydrogène.
le Potentiel hydrogène (pH) détermine à quel point la solution est acide. Sur l'échelle de pH, qui va d'une valeur de 1 pour l'acidité maximale à 14, qui est l'alcalinité ou la basicité complète, le caractère acide va des valeurs 1 à 6, et l'alcalin est compris entre 8 et 14. 7 représente un pH neutre; ni acide ni basique. Le résultat du logarithme négatif de la concentration H + nous dira où nous en sommes sur l'échelle.
Exemples d'acides :
Acide chlorhydrique: HCl: H+ + Cl-
Acide bromhydrique: HBr: H+ + Br-
Acide sulfurique: H2S: 2H+ + S-2
Acide cyanhydrique: HCN: H+ + CN-
Acide chlorhydrique: HI: H+ + je-
Exemples d'Oxyacides :
Acide sulfurique: H2SW4: 2H+ + AINSI4-2
Acide carbonique: H2CO3: 2H+ + CO3-2
Acide nitrique: HNO3: H+ + NON3-
Acide phosphorique: H3Bon de commande4: 3H+ + Bon de commande4-3
Acide perchlorique: HClO4: H+ + ClO4-
Exemples d'hydroxydes :
Hydroxyde de sodium: NaOH: Na+ + OH-
Hydroxyde de calcium: Ca (OH)2: Californie+ + 2OH-
Hydroxyde d'ammonium: NH4OH: NH4+ + OH-
Hydroxyde de potassium: KOH: K+ + OH-
Hydroxyde de magnésium: Mg (OH)2: mg+ + 2OH-
Molécules inorganiques dans les réactions chimiques
Lorsque des molécules inorganiques participent à une réaction chimique, il peut y avoir quatre mécanismes de réaction basiques et simples: Synthèse, décomposition, substitution simple et substitution double. Voici un exemple de chacun :
La synthèse
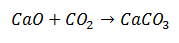
Une réaction de synthèse est une réaction dans laquelle deux molécules se réunissent dans un produit final constitué d'une seule molécule. Dans l'exemple, c'est le cas de l'oxyde de calcium combiné au dioxyde de carbone pour former une molécule de carbonate de calcium.
Décomposition:

Une réaction de décomposition est une réaction dans laquelle une molécule initiale se sépare en deux nouvelles molécules stables. Tel est le cas de l'hydroxyde de calcium, se séparant en une molécule d'oxyde de calcium et une autre d'eau.
Remplacement simple :

Dans une réaction de substitution simple, un atome d'un élément est échangé avec l'un des atomes d'une molécule. Tel est le cas du zinc métallique, se plaçant à la place de l'hydrogène dans le chlorure d'hydrogène, le libérant et formant des molécules de chlorure de zinc.
Double substitution :
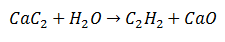
Dans une réaction de double substitution, certains atomes de deux molécules initiales sont échangés, pour générer comme produits deux molécules différentes. C'est le cas du Carbure de Calcium, qui subit la libération de Carbone, qui va se combiner avec l'Hydrogène de l'Eau pour former de l'Acétylène. Le calcium se lie à l'oxygène pour former de l'oxyde de calcium en tant que deuxième produit.
Molécules organiques
La chimie organique est la chimie du carbone, ce qui signifie que toutes les molécules organiques auront la présence de cet élément, dans différents arrangements structurels.
Les molécules organiques sont caractérisées par présence constante de liaisons covalentes. Liaisons covalentes avec celles dans lesquelles deux atomes se rejoignent pour partager leurs électrons de valence et ainsi compléter mutuellement leurs octets.
C'est le cas du Carbone, qui se lie à d'autres atomes du même élément. Des chaînes de longueurs très variées se forment, de deux à soixante atomes de carbone, et même ces chaînes ils se ramifient avec d'autres chaînes avec la même variété de longueurs, réalisant une immense diversité de molécules biologique.
Des liaisons ioniques sont également présentes, mais elles se produisent dans les étapes intermédiaires de longs mécanismes de réaction dans lesquels une molécule souhaitée est formée.
Les molécules organiques les plus simples comprennent le carbone et l'hydrogène. Ce dernier complète la valence carbone qui le requiert.
En chimie organique, les molécules peuvent être linéaires ou aliphatiques, ramifiées, cycliques et aromatiques.
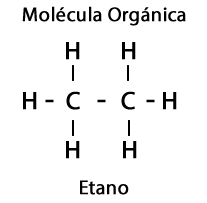
De plus, les éléments Oxygène, Azote, Soufre et Phosphore sont impliqués dans les Molécules Organiques, ce qui donne lieu à une diversité impressionnante de Groupes Fonctionnels pour les molécules.
Groupes fonctionnels dans les molécules organiques
Les Les groupes fonctionnels sont des groupes de deux atomes ou plus qui, en joignant une chaîne Carbone-Hydrogène, forment différentes espèces chimiques, avec un comportement particulier. Ensuite, les sept principaux types de molécules organiques sont répertoriés, avec leurs groupes fonctionnels respectifs. La lettre "R" est utilisée pour désigner la chaîne Carbone-Hydrogène.
Halogénures d'alkyle - Forme: R-X / Groupe fonctionnel: Un élément Halogène (Chlore, Brome, Iode)

Alcools - Forme: R-OH / Groupe fonctionnel: -OH ou hydroxyle.
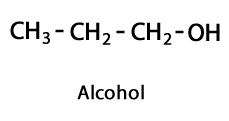
Aldéhydes - Forme: R-CHO / Groupe fonctionnel: -CHO, qui va toujours en bout de chaîne.
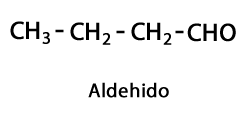
Cétones - Forme: R-CO-R / Groupe Fonctionnel: -CO- ou Carboxy, toujours au milieu Carbone de la chaîne.
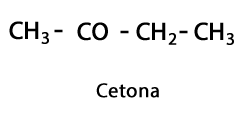
Acides organiques - Forme: R-COOH / Groupe Fonctionnel: -COOH ou Carboxyle, toujours en bout de chaîne.
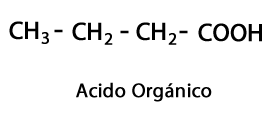
Esters acides - Forme: R-COO-R / Groupe fonctionnel: -COO-, est le résultat de la jonction d'une chaîne acide avec une autre chaîne Carbone-Hydrogène.
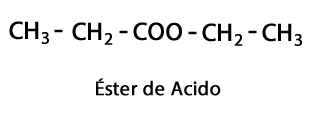
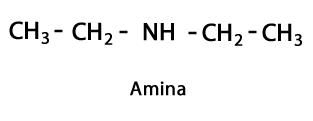
Amines - Forme: R-NH2, R-NH-R, R-N-2R / Groupe fonctionnel: -NH2, -NH-, -N = ou Amino, qui est un Azote additionné d'Hydrogène aux endroits où il n'y a pas de chaîne Carbone-Hydrogène. Comme indiqué, il peut aller au bout de la chaîne, ou au milieu. L'atome d'azote peut être accompagné d'une, deux ou trois chaînes organiques pour former une molécule finale. Les amines peuvent être considérées comme des dérivés organiques de l'ammoniac NH3.
Molécules organiques dans les réactions chimiques
Les molécules organiques, plus leurs chaînes Carbone-Hydrogène sont longues, plus il y a de sites ou d'atomes disponibles pour participer à une réaction chimique.
Le plus souvent, des éléments ou des chaînes sont ajoutés à l'un des carbones présents, ou une partie de la chaîne principale est détachée pour générer un composé organique différent.
Comme de telles réactions sont lentes, des catalyseurs sont utilisés, qui sont des agents chimiques pour accélérer les réactions. Dans certains cas, le catalyseur est un maillage fin de métal platine.
Exemples de molécules inorganiques
Chlorure de sodium NaCl
Chlorure de potassium KCl
Chlorure d'ammonium NH4Cl
Nitrate de sodium NaNO3
Nitrate de potassium KNO3
Nitrate d'ammonium NH4NE PAS3
Acide sulfurique H2SW4
Acide phosphorique H3Bon de commande4
Acide phosphoreux H3Bon de commande3
Acide chlorhydrique HCl
Acide iodhydrique HI
Hydroxyde de sodium NaOH
Hydroxyde de potassium KOH
Hydroxyde d'ammonium NH4Oh
Hydroxyde de calcium Ca (OH)2
Hydroxyde de magnésium Mg (OH)2
Hydroxyde ferreux Fe (OH)2
Hydroxyde ferrique Fe (OH)3
Sulfure de fer FeS
Sulfate ferreux FeSO4
Sulfate ferrique Fe2(SW4)3
Exemples de molécules organiques
Glucose C6H12OU ALORS6
Méthane CH4
Éthane C2H6
Acétylène C2H2
Propane C3H8
Butane C4H10
Éthanol C2H6OU ALORS
Saccharose C12H22OU ALORS11
Méthanol CH4OU ALORS
Glycérol C3H8OU ALORS3



