धातुई बांड उदाहरण Bond
रसायन विज्ञान / / July 04, 2021
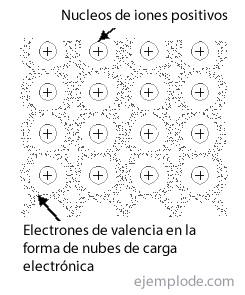
धातुई लिंक वह तरीका है जिससे किसी धातु के परमाणु a. में मिलने का प्रबंधन करते हैं क्रिस्टल की संरचना, स्थिर, का उपयोग कर इसके इलेक्ट्रॉनों के बादल, और शुद्ध पदार्थों के रूप में प्रकट होने के लिए आयनिक या सहसंयोजक बंधों की विशिष्टता पर निर्भर किए बिना। नामांकित किया गया है जाल धातु लिंक के समूह या व्यवस्था के लिए।
अधिकांश धातुएँ तीन प्रकार की व्यवस्थाओं में क्रिस्टलीकृत होती हैं: शरीर केंद्रित घन नेटवर्क, चेहरा केंद्रित घन नेटवर्क यू कॉम्पैक्ट हेक्सागोनल नेटवर्क.
के में शरीर केंद्रित, धातु का प्रत्येक परमाणु 14 पड़ोसियों से घिरा होता है, और अन्य में दो शेष 12 तक यदि आप ऐसी संरचनाओं के बंधन से निपटने का प्रयास करते हैं, तो आपको तुरंत इलेक्ट्रॉन अपर्याप्तता की समस्या मिल जाएगी। इस प्रकार, लिथियम के मामले में एक एकल वैलेंस इलेक्ट्रॉन और 14 करीबी पड़ोसियों के साथ, यह समझाया जाना चाहिए कि यह तत्व कैसा है इतनी बड़ी संख्या में परमाणुओं से घिरा हुआ है, और फिर भी यह इतना स्थिर क्रिस्टल उत्पन्न करता है कि. का गलनांक हो 186 डिग्री सेल्सियस ऐसा ही अन्य धातुओं के साथ भी होता है।
स्विस भौतिक विज्ञानी फेलिक्स ब्लोच
1928 में उन्होंने धात्विक क्रिस्टल में परमाणुओं के बंधन की व्याख्या करने के लिए एक क्वांटम यांत्रिक सिद्धांत का प्रस्ताव रखा। इसमें बैंड थ्योरी एक परमाणु में पूरी तरह से भरे हुए ऊर्जा स्तरों पर मौजूद सभी इलेक्ट्रॉनों को अनिवार्य रूप से माना जाता है स्थित, अर्थात्, उन परमाणुओं से बंधा हुआ है जिनसे वे जुड़े हुए हैं। दूसरी ओर, अधूरे ऊर्जा स्तरों में वैलेंस इलेक्ट्रॉनों को माना जाता है नि: शुल्क, और वे एक संभावित क्षेत्र में चलते हैं जो क्रिस्टल में मौजूद सभी परमाणुओं तक फैलता है।परमाणु कक्षक एक परमाणु में इन मुक्त इलेक्ट्रॉनों की ओवरलैप दूसरों की उत्पत्ति के साथ विस्थापित आणविक कक्षाएँ जो मौजूद सभी परमाणुओं के बीच एक बंधन उत्पन्न करता है, और जिसे. के नाम से जाना जाता है चालन की कक्षाएँ।
उर्जा स्तर पृथक परमाणुओं में इलेक्ट्रॉनों की संख्या होती है विचारशील और आम तौर पर अच्छी तरह से दूरी. लेकिन क्रिस्टल में अन्य परमाणुओं की उपस्थिति प्रत्येक स्तर को a. में बदलकर इन स्तरों को प्रभावित करती है स्तर बैंड जिनकी संख्या संरचनात्मक समग्रता में उपस्थित परमाणुओं की संख्या के बराबर होती है। यदि यह संख्या बड़ी है, तो प्रत्येक पृथक स्तर व्यावहारिक रूप से बनता है a निरंतर बैंड. साथ ही, जब धातु में मूल स्तरों और परमाणुओं के बीच का स्थान बड़ा होता है, तब प्रारंभिक इलेक्ट्रॉनिक स्तरों से उत्पन्न होने वाले बैंड एक दूसरे से अलग हो जाते हैं के लिये ऊर्जा अंतराल विचारणीय। जब स्तर और दूरियां छोटी होती हैं, तो बैंड होते हैं क्रॉस और ओवरलैप से प्रत्येक।
यह सिद्धांत किसी धातु की इलेक्ट्रॉनिक संरचना का निम्नलिखित विवरण प्रदान करता है। ए ठोस धातु माना जाता है इलेक्ट्रॉन बैंड एक दूसरे से अलग ऊर्जा अंतराल. इसके अलावा, ये बैंड कभी-कभी पूरी तरह से स्थानीयकृत इलेक्ट्रॉनों से भरे होते हैं, या वे आंशिक रूप से मुक्त इलेक्ट्रॉनों से भरे होते हैं जिनके आणविक ऑर्बिटल्स क्रिस्टल के सभी परमाणुओं तक फैले होते हैं।