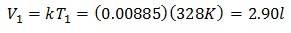रासायनिक तत्वों का उदाहरण
रसायन विज्ञान / / July 04, 2021
एक रासायनिक तत्व एक शुद्ध पदार्थ है जो एक ही प्रकार के परमाणुओं से बना होता है, जो बदले में नाभिक में कई प्रोटॉन और न्यूट्रॉन और उनकी कक्षा में कई इलेक्ट्रॉनों से बना होता है। कुछ प्राकृतिक रूप से पाए जाते हैं, अन्य एक यौगिक के अणुओं का निर्माण करके, और अन्य को प्रयोगशाला प्रक्रियाओं के निष्पादन के माध्यम से बनाया गया है। सभी रासायनिक तत्व पूरे ब्रह्मांड का निर्माण करते हैं, और मानव शरीर के अस्तित्व और कामकाज को बनाए रखते हैं।
प्रत्येक तत्व में विशेषताएँ और व्यवहार होते हैं जो इसे एक भेद देते हैं और इसे अद्वितीय बनाते हैं, लेकिन साथ ही यह उन तत्वों के समूह के साथ समानता प्रस्तुत करता है जो उनके पास हैं ब्रम्हांड। इस कारण से, रासायनिक तत्वों की आवर्त सारणी है, जो इन समानताओं को तत्वों को सुसंगत रूप से समूहित करने के लिए संबोधित करती है, और उनके गुणों का अध्ययन करना आसान बनाती है।
किसी तत्व का परमाणु क्रमांक
परमाणु नाभिक में समान संख्या में न्यूट्रॉन के साथ कई प्रोटॉन ले जाता है। इस संख्या को परमाणु संख्या कहा जाता है, जिसे के रूप में दर्शाया जाता है जेड शैक्षणिक उद्देश्यों के लिए और साहित्य में। प्रत्येक तत्व के लिए यह संख्या अद्वितीय होगी। समान परमाणु क्रमांक वाले दो तत्व नहीं हैं। आवर्त सारणी भी उन्हें आदेश देने के लिए इस मानदंड पर केंद्रित है।
एक तत्व का प्रतीक
कीमिया के समय में, जो लगभग ४०० से १००० ईस्वी तक फैला था। सी।, कीमियागर ने तत्वों को प्रतीक निर्दिष्ट करते हुए अपने प्रयोग दर्ज किए। वे सरल प्रतीक थे, जो ज्यामितीय आकृतियों से बने थे, जो व्यक्तिगत तत्व और अध्ययन किए गए परिवर्तनों का प्रतिनिधित्व करने के लिए थे।

रासायनिक प्रतीकों के कुछ उदाहरण, उनके द्वारा दर्शाए गए तत्व या यौगिक के नाम के साथ।
आधुनिक रसायन विज्ञान के युग में, तत्वों को अभी भी प्रतीकों के साथ दर्शाया जाता है, इस मामले में अक्षर जो लैटिन या अंग्रेजी में उनके नाम का उल्लेख करते हैं।
रासायनिक प्रतीकों के उदाहरण:
सोडियम का प्रतीक है ना, इसके लैटिन नाम से नाट्रियम
सोने का प्रतीक है औ, इसके लैटिन नाम से ऑरम
चांदी का प्रतीक है एजी, इसके लैटिन नाम से चांदी
कॉपर का प्रतीक है घन, इसके लैटिन नाम से तांबा
सुरमा का प्रतीक है एसबी, इसके लैटिन नाम से स्टिबियम
लोहे का प्रतीक है आस्था, इसके लैटिन नाम से फेरम
बुध का प्रतीक है एचजी, इसके लैटिन नाम से हाइड्रारग्यरम, जिसका अर्थ है "तरल चांदी"
पोटैशियम का प्रतीक है क, इसके लैटिन नाम से पोटैशियम
रासायनिक तत्व समूह
रासायनिक तत्वों की आवर्त सारणी इन्हें समूहों द्वारा वर्गीकृत करती है: समूह ए और समूह बी। आठ समूह ए हैं, जिनमें क्षारीय तत्व, क्षारीय-पृथ्वी तत्व, पृथ्वी तत्व, तत्वों के तीन परिवार शामिल हैं, जिनके सिर परिवार के नाम को परिभाषित करता है: कार्बन परिवार, नाइट्रोजन परिवार, सल्फर परिवार, हलोजन और गैसें रईस। समूह बी सभी संक्रमण धातुओं और दुर्लभ पृथ्वी से बना है, जो दो बड़े परिवार भी हैं: लैंथेनाइड्स और एक्टिनाइड्स।
समूह IA: क्षारीय तत्व
क्षारीय तत्वों की श्रृंखला हाइड्रोजन (H), लिथियम (Li), सोडियम (Na), पोटेशियम (K), रुबिडियम (Rb), सीज़ियम (Cs) और फ्रांसियम (Fr) से बनी होती है। इन सभी में एक इलेक्ट्रॉनिक विन्यास होता है जैसे कि अंतिम कोश में उनके पास एक इलेक्ट्रॉन होता है। उनका नाम इस तथ्य के कारण है कि जब वे पानी के संपर्क में आते हैं, तो वे क्षार या हाइड्रॉक्साइड बनाते हैं। यह इन तत्वों के बीच एक सामान्य व्यवहार है। तत्व का परमाणु जितना बड़ा होता है, वह उतना ही अधिक प्रतिक्रियाशील होता है, क्योंकि जिस बल से नाभिक अंतिम कोश से इलेक्ट्रॉन को बनाए रखता है, उसकी पहुंच कम होती जाती है। वे हैलोजन के साथ आयनिक बंधन बनाने में सक्षम हैं। उदाहरण के लिए: आयनिक बंधन जिसमें प्रचुर मात्रा में उपस्थिति होती है, वह सोडियम-क्लोरीन का होता है, जिससे सोडियम क्लोराइड बनता है सोडियम क्लोराइड.
समूह IIA: क्षारीय-पृथ्वी तत्व
ये तत्व हैं: बेरिलियम (बीई), मैग्नीशियम (एमजी), कैल्शियम (सीए), स्ट्रोंटियम (सीनियर), बेरियम (बीए) और रेडियम (आरए)। वे प्रकृति में स्वतंत्र नहीं हैं; दूसरी ओर, इसके कार्बोनेट और सिलिकेट सापेक्ष बहुतायत में मौजूद हैं। वे अर्जेंटीना के सफेद और क्रिस्टलीय हैं। हवा के संपर्क में आने पर वे आसानी से ऑक्सीजन के साथ जुड़ जाते हैं। यह आंशिक रूप से इस तथ्य के कारण है कि उनके अंतिम कोश में दो इलेक्ट्रॉन होते हैं, जो ऑक्सीजन प्राप्त करने की क्षमता के अनुरूप होते हैं। बेरियम समूह का सबसे सक्रिय तत्व है, और कैल्शियम के साथ, उनके पास समूह में सबसे अधिक औद्योगिक अनुप्रयोग हैं।
समूह IIIA: पृथ्वी तत्व
समूह IIIA में बोरॉन (B), एल्युमिनियम (Al), गैलियम (Ga), इंडियम (In) और थैलियम (Tl) तत्व शामिल हैं। बोरॉन एक अधात्विक तत्व है, एल्युमिनियम उभयधर्मी (एम्फीप्रोटिक) है, अर्थात यह अम्ल और क्षार के रूप में कार्य करने में सक्षम है; और अन्य तीन धात्विक तत्व हैं। उनके अंतिम शेल में तीन इलेक्ट्रॉन होते हैं, जो +3 की वैलेंस उत्पन्न करते हैं, हालांकि कभी-कभी गैलियम अपने कुछ यौगिकों में +1 और +2 वैलेंस के साथ कार्य करता है। इस श्रृंखला में बोरॉन एकमात्र तत्व है जो हाइड्राइड्स बनाता है। बोरॉन और एल्युमिनियम कार्बाइड बनाते हैं।
समूह IVA: कार्बन परिवार
समूह IVA के प्रतिनिधि तत्व कार्बन (C), सिलिकॉन (Si), जर्मेनियम (Ge), टिन (Sn) और लेड (Pb) हैं। पहले दो अपनी विशेषताओं में मौलिक रूप से गैर-धातु हैं, लेकिन जर्मेनियम, टिन और लेड धात्विक हैं, और जितना अधिक उनकी परमाणु संख्या उतनी ही अधिक होती है। सिलिकॉन के अपवाद के साथ, प्रत्येक तत्व में वैलेंस +4 और +2 होते हैं।
कार्बन और सिलिकॉन यौगिक बनाते हैं जिसमें तत्वों के परमाणु साझा इलेक्ट्रॉनों के जोड़े से जुड़ते हैं। कार्बन हाइड्रोजन, ऑक्सीजन, नाइट्रोजन, सल्फर और कभी-कभी सिलिकॉन के परमाणुओं के साथ जुड़कर कार्बनिक यौगिकों का सार है।
सिलिकॉन और जर्मेनियम का उपयोग इलेक्ट्रॉनिक घटकों के निर्माण के लिए किया जाता है, क्योंकि उनमें अर्धचालक की तरह व्यवहार करने का गुण होता है।
समूह वीए: नाइट्रोजन परिवार
समूह VA में नाइट्रोजन (N), फास्फोरस (P), आर्सेनिक (As), सुरमा (Sb) और बिस्मथ (Bi) तत्व शामिल हैं। नाइट्रोजन और फास्फोरस अधात्विक हैं, आर्सेनिक और सुरमा धातु हैं, और बिस्मथ एक धातु है। इन तत्वों को हाइड्राइड बनाने की विशेषता है, जिनमें से कम से कम विषाक्त अमोनिया NH. है3. नाइट्रोजन नाइट्रिक एसिड बनाता है HNO3, अगुआ रेजिया में हाइड्रोक्लोरिक एसिड के साथ मिलकर, सोने और चांदी जैसी कीमती धातुओं को घोलने में सक्षम मिश्रण।
नाइट्रोजन भी कार्बनिक यौगिकों के दो बड़े समूहों में शामिल है जिन्हें अमीन्स और एमाइड्स कहा जाता है, जिन्हें अमोनिया NH का व्युत्पन्न माना जा सकता है।3, एक हाइड्रोकार्बन श्रृंखला द्वारा हाइड्रोजन के प्रतिस्थापन द्वारा।
समूह के माध्यम से: ऑक्सीजन परिवार
ऑक्सीजन (O), सल्फर (S), सेलेनियम (Se), टेल्यूरियम (Te) और पोलोनियम (Po) तत्वों से बना है। ऑक्सीजन सबसे अधिक सक्रिय है, और आसानी से सहसंयोजक बंधन बनाने की क्षमता रखती है। उच्च आर्द्रता वाले वातावरण में धातुओं के संपर्क में आने पर यह ऑक्साइड बनाता है। यह ओजोन नामक एक गुंजयमान अणु बनाता है, जो ग्रह को यूवी विकिरण से बचाता है।
समूह VIIA: हैलोजन
इसके नाम का अर्थ है "बिक्री पूर्व"। यह समूह फ्लोर (F), क्लोरीन (Cl), ब्रोमीन (Br), आयोडीन (I) और एस्टेट (At) तत्वों से बना है। उनके अंतिम कोश में सात इलेक्ट्रॉन होते हैं, जो उन्हें एक इलेक्ट्रॉन के लिए ग्राही बनने की अनुमति देता है। यह गुण उन्हें समूह IA के तत्वों से जोड़ता है, जिससे बाइनरी लवण बनते हैं। फ्लोर को संपूर्ण आवर्त सारणी की सबसे बड़ी इलेक्ट्रोनगेटिविटी होने की विशेषता है, जिसका मान 4.0 है, इसका समकक्ष सीज़ियम है, 0.7 की वैद्युतीयऋणात्मकता के साथ। यह गुण इसे अन्य परमाणुओं को आकर्षित करने की ताकत देता है और इसके साथ एक बंधन बनाने को प्राथमिकता देता है वे।
समूह VIIIA: नोबल गैसें
अक्रिय गैस समूह भी कहा जाता है, यह हीलियम (He), नियॉन (Ne), आर्गन (Ar), क्रिप्टन (Kr), क्सीनन (Xe) और रेडॉन (Ra) तत्वों से बना है। वे ऐसे तत्व हैं जिनके सभी इलेक्ट्रॉनिक विन्यास हैं, इसलिए वे सामान्य परिस्थितियों में प्रतिक्रिया करने में सक्षम नहीं हैं। वे मुख्य रूप से चमकदार वाणिज्यिक संकेतों के लिए उपयोग किए जाते हैं, जब उन पर विद्युत प्रवाह होता है तो दृश्य प्रकाश उत्सर्जित करते हैं।
समूह बी: संक्रमण धातु
तीन तत्वों के दस समूहों में, संक्रमण धातुओं को समूहीकृत किया जाता है। इनमें सर्वश्रेष्ठ विद्युत कंडक्टर शामिल हैं: सिल्वर (एजी), कॉपर (सीयू), गोल्ड (एयू); शहरी निर्माण और इंजीनियरिंग के लिए सर्वोत्तम संरचनात्मक घटक; आयरन (Fe), टाइटेनियम (Ti), एल्युमिनियम (Al), ज़िरकोनियम (Zr), टंगस्टन (W); सबसे अच्छा उत्प्रेरक घटक: निकल (नी), वैनेडियम (वी), प्लेटिनम (पीटी); और मुख्य कोटिंग सामग्री: कैडमियम (सीडी), क्रोमियम (सीआर), जिंक (जेडएन)। वे आमतौर पर +1 और +3 के बीच संयोजकता को संभालते हैं, लेकिन क्रोमियम जैसे तत्व संयोजकता +2, +3, +6 संभालते हैं।
दुर्लभ पृथ्वी: लैंथेनाइड्स और एक्टिनाइड्स
ग्रह पर उनकी कमी के कारण उन्हें दुर्लभ पृथ्वी कहा जाता है। वे दो समूहों से बने होते हैं: लैंथेनाइड्स और एक्टिनाइड्स। वे आवर्त सारणी की दो अलग-अलग पंक्तियों पर पाए जाते हैं। वे आम तौर पर +3 की वैलेंस के साथ काम करते हैं, और हाइड्रॉक्साइड बनाते हैं। उनमें से सबसे महत्वपूर्ण तत्व सेरियम है, जिसका उपयोग पायरोफोरिक मिश्र (मिश्र धातु) की तैयारी में किया जाता है मिशमेटल, लाइटर के लिए पत्थरों के लिए), प्रकाश के लिए गैस होसेस में और विशेष चश्मे के निर्माण में जो पराबैंगनी किरणों और गर्मी विकिरण को अवशोषित करते हैं।
सबसे शक्तिशाली रेडियोधर्मी तत्व, जैसे यूरेनियम (यू) और प्लूटोनियम (पु), इन समूहों का हिस्सा हैं। जो उनकी अस्थिरता को देखते हुए, ऊर्जा छोड़ते हैं और विघटित हो जाते हैं, अल्फा कणों को खो देते हैं हीलियम)। रेडियोधर्मी श्रेणी के अनुसार बाद में वे कम अस्थिर तत्व बन जाते हैं।