20 Primjeri kiselinskih soli
Miscelanea / / July 04, 2021
U anorganska kemija soli se nazivaju spojevi koji se dobivaju kada a kiselina njegovi atomi vodika zamjenjuju se metalnim kationima (iako ponekad nemetalnim kationima, na primjer, amonijevim kationom, NH4+). U konkretnom slučaju kiselinske soli, vodikovi kiseline su djelomično supstituirani, tj. najmanje jedan nesupstituirani vodik ostaje kao dio soli. U tome što se razlikuju od neutralne soli, gdje su vodikovi kiseline potpuno supstituirani.
The Izađi van obično nastaju reakcijom između a kiselina i a hidroksid (baza). U tim reakcijama baza obično gubi svoje hidroksilne skupine (-OH), a kiselina ih gubi. atoma vodik (H), tvoreći neutralnu sol; ali ako dotična kiselina sačuva barem jedan od svojih atoma vodika, mijenjajući električni naboj reakcije, dobit ćemo kiselu sol ili hidrogeniranu sol.
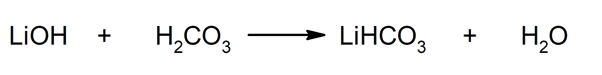
Tako se, na primjer, litijev bikarbonat i voda dobivaju reakcijom između litijevog hidroksida i ugljične kiseline:
Nomenklatura kiselinskih soli
Kiselinske soli mogu se imenovati prema tri vrste najčešća nomenklatura:
Primjeri kiselinskih soli
- Natrijev bikarbonat (NaHCO3). Također se naziva natrijev hidrogen karbonat (IV), to je bijela kristalna krutina, topljiva u vodi, koja se može naći u prirodi u državi mineral ili se može proizvesti u laboratoriju. Jedna je od najpoznatijih kiselinskih soli i široko se koristi u slastičarstvu, farmakologiji ili u proizvodnji jogurta.
- Litij bikarbonat (LiHCO3). Ova kiselinska sol korištena je kao sredstvo za hvatanje CO2 u situacijama kada je takav plin nepoželjan, kao u sjevernoameričkim svemirskim misijama "Apollo".
- Kalij dihidrogen fosfat (KH2PO4). Kristalna je krutina, bez mirisa, topljiva u vodi, široko korištena u raznim industrijama poput kvasca hrana, helatno sredstvo, hranjivo sredstvo za pojačavanje i pomoćnik u fermentacijskim procesima.
- Natrijev bisulfat (NaHSO4). To je kisela sol koja nastaje neutralizacijom sumporne kiseline. Široko se koristi u rafiniranju metala i proizvodima za čišćenje. Iako je vrlo toksičan za neke iglokožce, koristi se kao dodatak hrani za kućne ljubimce i u proizvodnji nakita.
- Natrijev sumporovodik (NaHS). S njim je opasan spoj, jer je vrlo korozivan i toksičan. Može izazvati ozbiljne opekline kože i oštećenja oka jer je također zapaljiv.
- Kalcijev hidrogen fosfat (CaHPO4). Koristi se kao dodatak prehrani u žitarice za stoku. Čvrsta je supstanca netopiva u vodi, ali kad kristalizira kad je hidratizira konzumiranjem dvije molekule od vode.
- Amonijev hidrogenkarbonat ([NH4] HCO3). Također poznat kao "amonijev bikarbonat", koristi se u prehrambenoj industriji kao kvasac kemijska, iako ima nedostatak uhvatiti amonijak i dati hrani neukus ako se koristi višak. Također se koristi u aparatima za gašenje požara, za proizvodnju pigmenata i za širenje gume.
- Bari bikarbonatili (Ba [HCO3]2). To je kisela sol koja zagrijavanjem može preokrenuti reakciju proizvodnje i vrlo je nestabilna, osim u otopini. Široko se koristi u keramičkoj industriji.
- Natrijev bisulfit (NaHSO3). Ta je sol izuzetno nestabilna i u prisutnosti kisika dobiva se u natrijev sulfat (Na2SW4), zbog čega se koristi u prehrambenoj industriji kao konzervans i sredstvo za sušenje. To je ekstremno reducirajuće sredstvo i često ga koristi čovjek, koristi se i za fiksiranje boja.
- Kalcijev citrat (AC3[C6H5ILI7]2). Obično poznata kao gorka sol, koristi se kao konzervans za hranu i kao dodatak prehrani kada je povezana s aminokiselinom lizinom. To je bijeli kristalni prah bez mirisa.
- Monokalcijev fosfat (Ca [H2PO4]2). To je bezbojna krutina koja se dobiva reakcijom kalcijevog hidroksida i fosforne kiseline, a široko se koristi kao sredstvo za kvašenje ili kao gnojivo u poljoprivrednim radovima.
- Dikalcijev fosfat (CaHPO4). Poznat i kao kalcijev monohidrogen fosfat, ima tri različita kristalna oblika koji se koriste kao dodatak hrani i prisutan je u zubnim pastama. Osim toga, prirodno nastaje u bubrežnim kamencima i u takozvanom "bubrežnom kamenu".
- Monomagnezijev fosfat (MgH4Str2ILI8). To je bijela, kristalna sol bez mirisa, djelomično topljiva u vodi. Koristi se za konzerviranje hrane, kao sredstvo za zakiseljavanje, kao korektor kiselosti ili sredstvo u liječenju brašna.
- Natrijev diacetat (NaH [C2H3ILI2]2). Ova sol koristi se kao aroma i konzervans u obrocima, što sprečava ili odgađa pojavu gljive i mikobakterije, kako u vakuumski upakiranim proizvodima poput mesnih proizvoda, tako i u industriji brašna.
- Kalcijev bikarbonat (Ca [HCO3]2). To je hidrogenirana sol koja potječe od kalcijevog karbonata, prisutnog u mineralima poput vapnenca, mramora i drugih. Ova reakcija uključuje prisutnost vode i CO2, pa se može spontano pojaviti u špiljama i špiljama bogatim kalcijem.
- Fluorid Rubidijeve kiseline (RbHF). Ta se sol dobiva reakcijom fluorovodične kiseline (vodik i fluor) i rubidija, alkalnog metala. Rezultat je otrovni i korozivni spoj s kojim se mora postupati oprezno.
- Monoamonijev fosfat ([NH4] H2PO4). To je sol topiva u vodi koja nastaje reakcijom amonijaka i fosforne kiseline. Obično se koristi kao gnojivo jer zemljištu daje hranjive tvari dušika i fosfora neophodnih za rast biljaka. Također je dio ABC praha u aparatima za gašenje požara.
- Cink hidrogen ortoborat (Zn [HBO3]). To je sol koja se koristi kao antiseptik i kao dodatak u proizvodnji keramike.
- Mononatrijev fosfat (NaH2PO4). Uglavnom se koristi u laboratorijima, kao "pufer" ili puferska otopina, koja sprječava nagle promjene pH otopine.
- Kalij hidrogen ftalat (KHP). Nazivan i "ftalat kalijeve kiseline", čvrsta je i stabilna sol u običnom zraku, zbog čega se često koristi kao primarni standard u mjerenjima pH. Također je koristan kao pufersko sredstvo u kemijske reakcije.
Slijedite sa: