100 primjera kemijskih elemenata
Miscelanea / / November 13, 2021
The kemijski elementi su vrsta materije koja nikakvim postupkom ili kemijska reakcija mogu se reducirati ili rastaviti na druge jednostavnije elemente. Iz tog se razloga može reći da je element sve materija izradio atoma iste i jedinstvene klase, odnosno atoma koji imaju isti atomski broj (jednak broj protona), iako imaju različitu atomsku masu. Na primjer: sumpor, bor, krom, kositar.
Prvu definiciju kemijskog elementa uveo je Lavoisier u Traité Élémentaire de Chimie, 1789. godine. Još u 18. stoljeću Lavoisier je jednostavne tvari podijelio u četiri skupine:
Periodni sustav elemenata
Danas se poznaju 118 kemijskih elemenata. Svi su okupljeni, klasificirani i organizirani prema mnogim svojim svojstvima u grafičkoj shemi poznatoj kao Periodni sustav elemenata, koju je izvorno stvorio ruski kemičar Dimitri Mendeleyev 1869. god. Periodni sustav sastoji se od 18 skupina (stupaca) i 7 razdoblja (redova) u kojima se nalaze kemijski elementi.
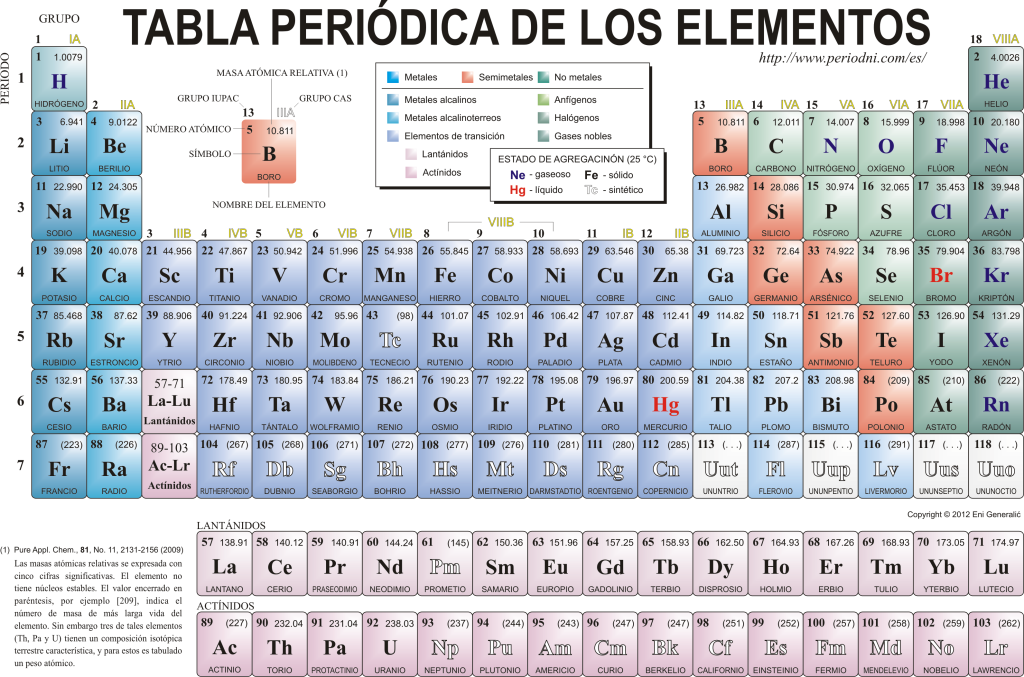
The glavne skupine koje se mogu naći u ovoj tablici su:
Alkalni metali (skupina 1), zemnoalkalijski metali (skupina 2), porodica skandij, koja uključuje zemlje i aktinidi (skupina 3), obitelj titana (Skupina 4), obitelj vanadija (skupina 5), obitelj kroma (skupina 6), obitelj mangana (skupina 7), obitelj željeza (skupina 8), obitelj kobalta (skupina 9), obitelj nikla (skupina 10), obitelj bakra (skupina 11), obitelj cinka (skupina 12), zemljani elementi (skupina 13), karbonidi, u ovu skupinu spadaju Ugljik, koji je osnova života na Zemlji (skupina 14), elementi koji tvore dušik (skupina 15), amfigenetski elementi, uključuju kisik, temeljni element za disanje od živa bića (Skupina 16), halogeni elementi (skupina 17) i plemeniti plinovi (skupina 18).
Mnogi od ovih elemenata imaju stabilni ili radioaktivni izotopi, odnosno isti kemijski element, na primjer, vodik (H), može imati nekoliko izotopa (1H, 2H, 3H). To znači da svaki atom izotopa ima jednak broj protona (što podrazumijeva da pripada istom kemijskom elementu) i različit broj neutrona.
Neki izotopi nisu stabilni (radioaktivni), tj. raspasti se u određenom vremenu emitirajući određene čestice (između ostalih neutrone, fotone, alfa čestice) i stvara druge stabilne ili radioaktivne izotope. Kemijski elementi imaju svojstva kao što je točka ključanje i to od fuzija, elektronegativnost, gustoća i jonski radijus, između ostalih. Ta su svojstva važna jer nam omogućuju predviđanje njegovog ponašanja, reaktivnosti itd.
Kako su elementi predstavljeni u Periodnom sustavu?
Svaki kemijski element karakteriziran je u Periodni sustav elemenata koristeći određenu simbologiju. Na prvom mjestu, u središtu svakog kvadrata njegov univerzalni simbol, koji se sastoji od jednog ili dva slova (prema dogovoru, ako postoje dva slova, prvo se piše velikim, a sljedeće malim slovom).
Iznad i slijeva pojavljuje se u malim slovima su atomski broj, koji je onaj koji ukazuje na količinu protona koju ovaj element ima. Ispod simbola elementa pojavljuje se njegovo ime, a gore, s lijeve strane, njegovo ime. atomska masa srodnik. Uz to, boja u kojoj je simbol elementa predstavljen označava njegovo agregacijsko stanje (u skladu s prikazom koji se koristi u svakom Periodnom sustavu).
Prisutni su različiti elementi atomski radijusi varijable i, kako se broj protona u jezgri povećava, veća je privlačnost koju jezgra vrši na elektrone, pa atomski radijus teži smanjenju. Kad je atomski radijus malen, elektrone na najudaljenijoj razini oblaka jezgra jako privlači, pa se ne predaju lako. Suprotno se događa s elementima s visokim atomskim radijusima: oni se lako odriču svojih vanjskih elektrona.
Dakle, atomski radijus raste od vrha prema dnu kad prolazimo kroz skupine Periodnog sustava i smanjuje se slijeva udesno dok prolazimo kroz njihova razdoblja.
Primjeri kemijskih elemenata
| Kemijski element | Simbol |
| Actinium | Ac |
| Aluminij | Prema |
| Americium | A.M. |
| Antimon | Sb |
| Argon | Ar |
| Arsen | As |
| Astat | Na |
| Sumpor | S |
| Barij | Ba |
| Berilijum | Biti |
| Berkelium | Bk |
| Bizmut | Dvo |
| Bohrio | Bh |
| Bor | B |
| Brom | Br |
| Kadmij | CD |
| Kalcij | AC |
| Kalifornija | Usp |
| Ugljik | C |
| Cerij | EZ |
| Cezij | Cs |
| Klor | Kl |
| Kobalt | Co |
| Bakar | Cu |
| Krom | Cr |
| Kurij | Cm |
| Darmstadio | Ds |
| Disprozij | Dy |
| Dubnium | Db |
| Einsteinium | to je |
| Erbij | Er |
| Skandij | Sc |
| Kositar | S n |
| Stroncij | Gosp |
| Europium | Eu |
| Fermij | Fm |
| Fluor | F |
| Podudarnost | Str |
| Francije | Fr |
| Gadolinij | Gd |
| Galij | Ga |
| Germanij | Ge |
| Hafnij | Hf |
| Hassio | Hs |
| Helij | imam |
| Vodik | H |
| Željezo | Vjera |
| Holmij | Ho |
| Indijanac | U |
| Jod | Ja |
| Iridij | Ići |
| Itterbij | Yb |
| Itrij | Y |
| Kripton | Kr |
| Lantan | The |
| Lawrencio | Lr |
| Litij | Li |
| Lutecij | Ponedjeljak |
| Magnezij | Mg |
| Mangan | Mn |
| Meitnerius | Mt |
| Mendelevij | Doktor medicine |
| Merkur | Hg |
| Molibden | Mo |
| Neodimij | Na |
| Neon | Ne |
| Neptunij | Np |
| Niobij | Nb |
| Nikla | Ni |
| Dušik | N |
| Nobelio | Ne |
| Zlato | Au |
| Osmij | Vas |
| Kisik | ILI |
| Paladij | P.S |
| Srebro | Ag |
| Platina | Pt |
| voditi | Pb |
| Plutonij | Pu |
| Polonij | Po |
| Kalij | K |
| Prazeodim | Pr |
| Obećanje | P.m. |
| Protaktinijum | Godišnje |
| Radio | Ra |
| Radon | Rn |
| Renij | Ponovno |
| Rodij | Rh |
| Rubidij | Rb |
| Rutenij | Ru |
| Rutherfordio | Rf |
| Samarij | Vi |
| Seaborgio | Sg |
| Selen | Znam |
| Silicij | Da |
| Natrij | Na |
| Talij | Tl |
| Tantal | Ta |
| Tehnecij | Tc |
| Telur | Čaj |
| Terbij | Tb |
| Titan | Vas |
| Torij | Th |
| Tulij | Tm |
| Kopernik | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Ununoctium | Uuo |
| Ununpentium | Uup |
| Flerovio | Sp |
| Ununseptio | Uus |
| Ununtrij | Uut |
| Uran | ILI |
| Vanadij | V |
| Volfram | W |
| Ksenon | Xe |
| Cinkov | Zn |
| Cirkonij | Zr |

Slijedite sa:



