Definicija molekularne geometrije
Miscelanea / / January 11, 2022
Konceptualna definicija
To je struktura molekule koja određuje trodimenzionalni raspored atoma koji je čine u prostoru.

inženjer kemije
Molekularne geometrije trenutno su definirane na temelju Teorija odbijanja elektroničkih parova sloja Valencia (TRPECV). Ova teorija omogućuje predviđanje ponašanja kemijski tvari (posebno kovalentnih) i pomaže razumjeti distribucija elektronike, što dovodi do geometrija od molekula. To nam zauzvrat omogućuje razumijevanje mnogih svojstava koja tvari stječu.
Ova teorija temelji se na nizu temeljnih stupova koje ćemo pregledati, a zatim pokušati razumjeti njihove primjena praksa. Na prvom mjestu, vezani i nevezani (valentni) elektroni se smatraju morem elektrona koji, posjeduju istu vrstu naboja, odbijaju se međusobno, pa će uvijek biti smješteni što dalje od središnjeg atoma molekula.
Drugo, ovo "more" elektrona ili "elektronski oblak" tvori područja visoke gustoće elektrona, koji se sastoje u vezama, gdje su elektroni zajednički ili u parovima elektrona koji se ne dijele. Zauzvrat, veze koje se formiraju mogu biti jednostruke, dvostruke ili čak trostruke.
Konačno, za odlučiti molekularne geometrije, vrlo je korisno imati Lewisovu strukturu, gdje će se brojati količina gustoće elektrona oko središnjeg atoma i to će dati indikacija od naziva njegove geometrije i oblika koji molekula poprima trodimenzionalno.
Treba napomenuti da će te gustoće biti smještene što je moguće dalje, kako bi usvojile što stabilniju strukturu i gdje je manje odbijanja. Tako se prvo identificira elektronska geometrija, a zatim molekularna geometrija.
Šest razina gustoće
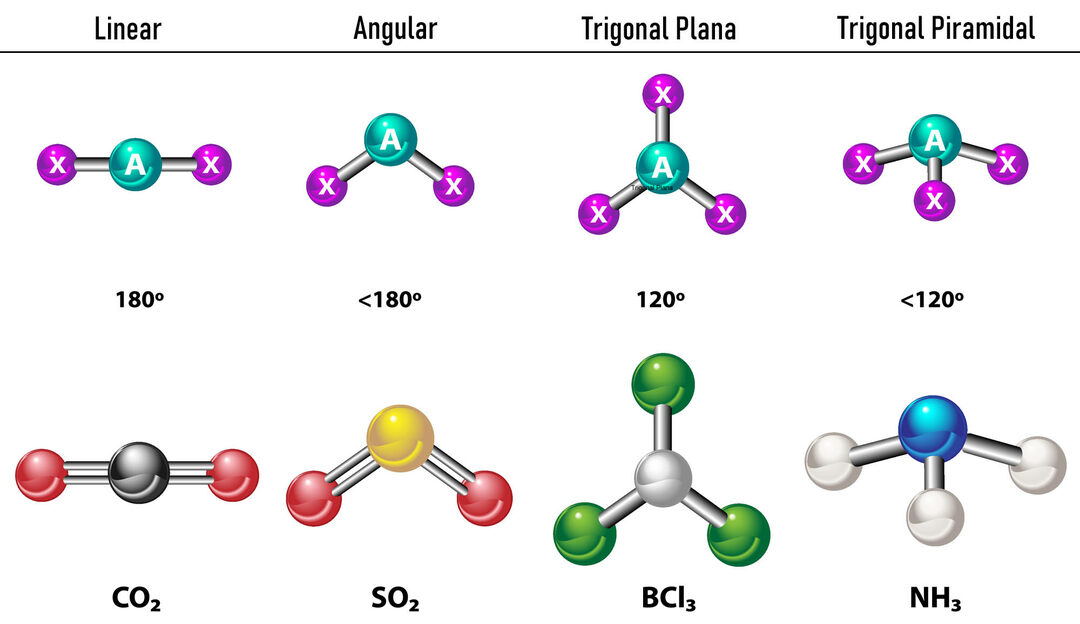
U slučaju da postoje dvije elektronske gustoće oko središnjeg atoma, veze će biti smještene što dalje jedna od druge između njih, to jest 180º jedan od drugog, pa je njihova elektronska geometrija linearna i molekularno također linearna.
U slučaju da oko središnjeg atoma postoje tri elektronske gustoće, postoje dvije mogućnosti: tri veze ili dvije veze i jedan nevezani par. Ako postoje tri veze, elektronska geometrija je Trigonalni stan, s kutovima od 120º između veza i molekularna geometrija nosi isto ime. Sada, ako postoji nevezani par, oni se odbijaju s više intenzitet da vezani naboji stoga teže komprimiranju veznih kutova. Kut između slobodnog para i svake veze je 120º, a elektronska geometrija je trigonalna ravnina, dok je molekularna geometrija kutna.
U slučaju da oko središnjeg atoma postoje četiri elektronske gustoće, elektronska geometrija je tetraedarska. Ako su sva četiri para elektrona vezana, njihova se molekularna geometrija po imenu podudara s njihovom elektronskom geometrijom, a kut veze je 109,5º. Sada, ako je jedan od parova slobodan, kut veze postaje manji (107º) i molekularna geometrija je tipa Trigonalna piramida. Konačno, ako su dva slobodna para, a dva vezana, kut veze je 104,5º, dok se molekularna geometrija naziva Kutni.
Kada je gustoća elektrona oko središnjeg atoma pet, to se naziva a Trigonalna bipiramida njegovu elektronsku geometriju. Ako su sva opterećenja povezana, između ekvatorijalno smještenih karika postoje kutovi od 120ºC i 90º između aksijalnih i ekviatorskih. Sada se molekularna geometrija također naziva trigonalna bipiramida, dok je, s četiri povezana para i jednim slobodnim parom, molekularna geometrija iskrivljena tvoreći dobro poznatu "rocker“, Tu je i ime koje dobiva Iskrivljeni tetraedar. Dok, ako su dva od pet parova elektrona slobodna, a tri od njih vezana, on ima geometriju u obliku slova "T" i ime mu je upravo zbog njegove strukture. Konačno, ako je obrnuto, tri slobodna para i dva vezana naboja, molekularna geometrija je linearna.
Konačno, oko središnjeg atoma postoji šest elektronskih gustoća i formira se oktaedar, otuda i njegovo ime u elektronskoj geometriji. Slično, molekularna geometrija se imenuje ako su svi njeni parovi povezani. Ako imate pet povezanih parova i jedan slobodni par, molekularna geometrija je piramida kvadratne baze. Ako imate četiri vezana para i dva slobodna para, molekularna geometrija je Kvadratni stan.
Slika: Slatka priroda
Teme iz molekularne geometrije
