30 Primjeri alkohola
Primjeri / / November 06, 2023
The alkoholi su organski kemijski spojevi koji u svojoj strukturi sadrže hidroksilnu funkcionalnu skupinu (- OH) vezanu na ugljik (- C). Skupina (- C – OH) naziva se "karbinol". Neki primjeri alkohola su: metanol, etanol i 1-propanol.
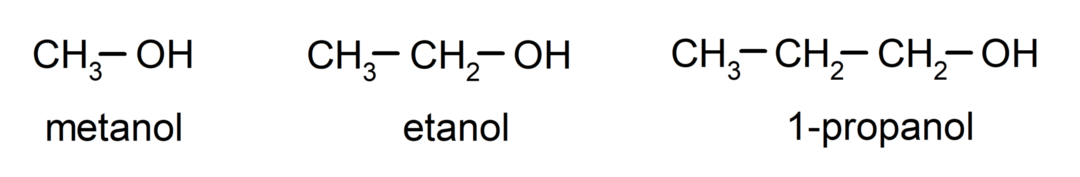
Alkoholi su kemijski spojevi koji imaju različitu primjenu u svakodnevnom životu jer imaju antibakterijska i antiseptička svojstva. S druge strane, mogu biti opasni za ljudsko zdravlje kada se nekontrolirano unose u organizam.
Isto tako, ljudi ne mogu unositi sve alkohole.
- Vidi također: Amini i ketoni
Vrste alkohola
Ovisno o broju ugljikovih atoma na koje je vezan ugljikov atom koji ima hidroksilnu skupinu, alkohol može biti:
- Primarni alkohol. Atom ugljika koji ima spojenu hidroksilnu skupinu također je vezan na jedan atom ugljika. Na primjer:
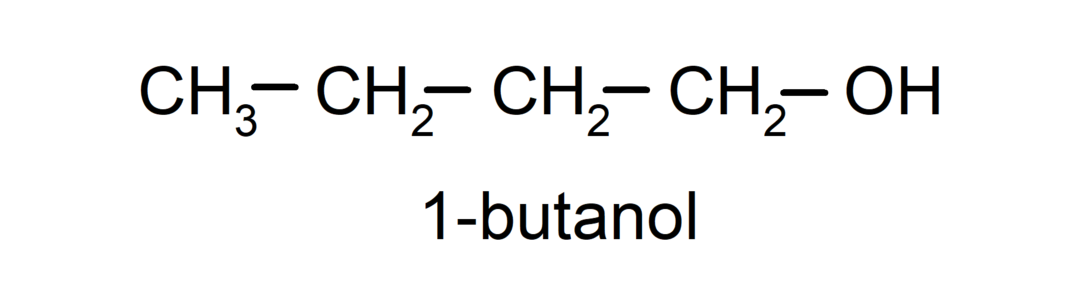
- Sekundarni alkohol. Atom ugljika koji ima spojenu hidroksilnu skupinu također je vezan na druga dva atoma ugljika. Na primjer:
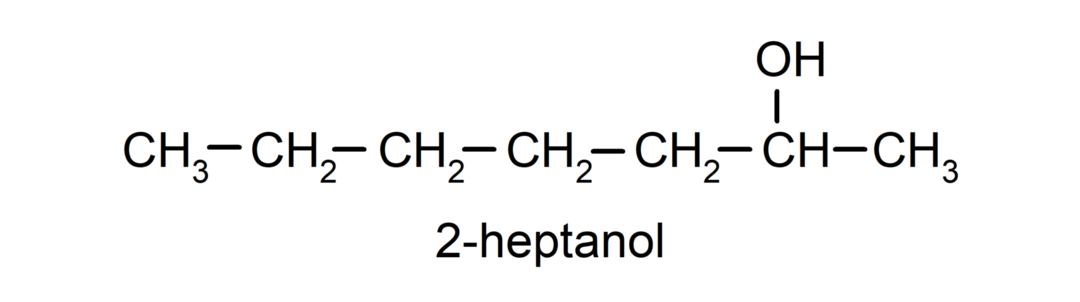
- Tercijarni alkohol. Atom ugljika koji ima spojenu hidroksilnu skupinu također je vezan na tri atoma ugljika. Na primjer:
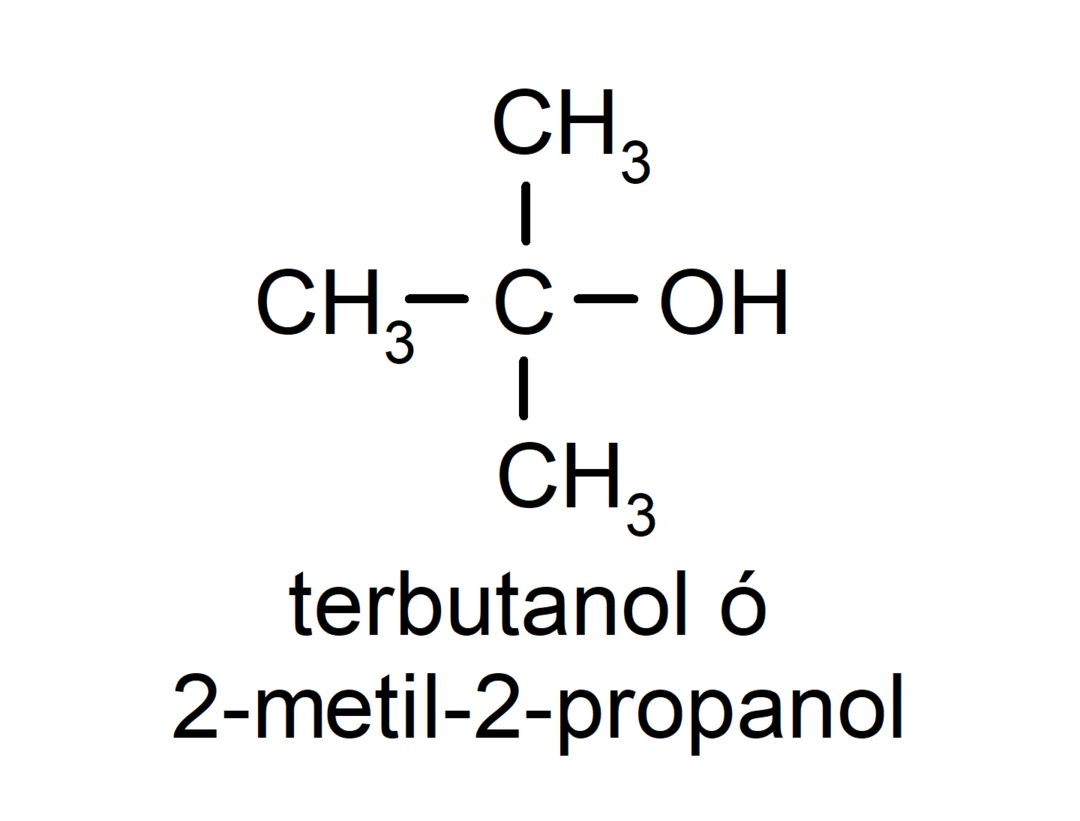
Ovisno o broju hidroksilnih skupina koje ima, alkohol može biti:
- Diol. U svojoj strukturi ima dvije hidroksilne skupine. Na primjer:
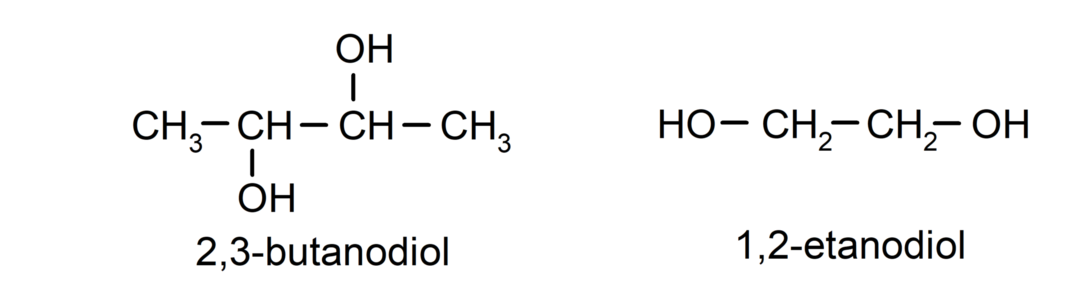
- Triol. U svojoj strukturi ima tri hidroksilne skupine. Na primjer:
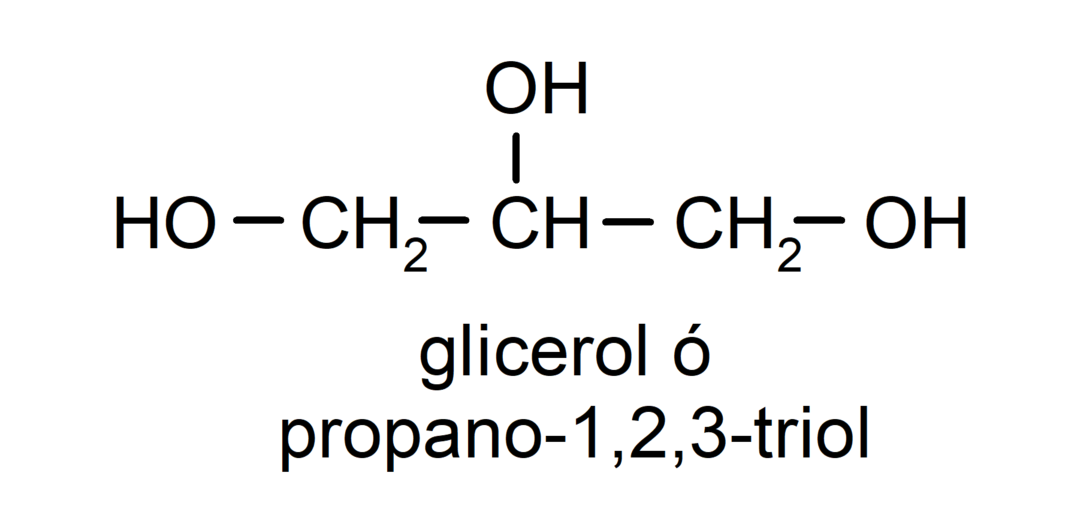
- Polialkohol. U svojoj strukturi ima mnogo hidroksilnih skupina. Na primjer:
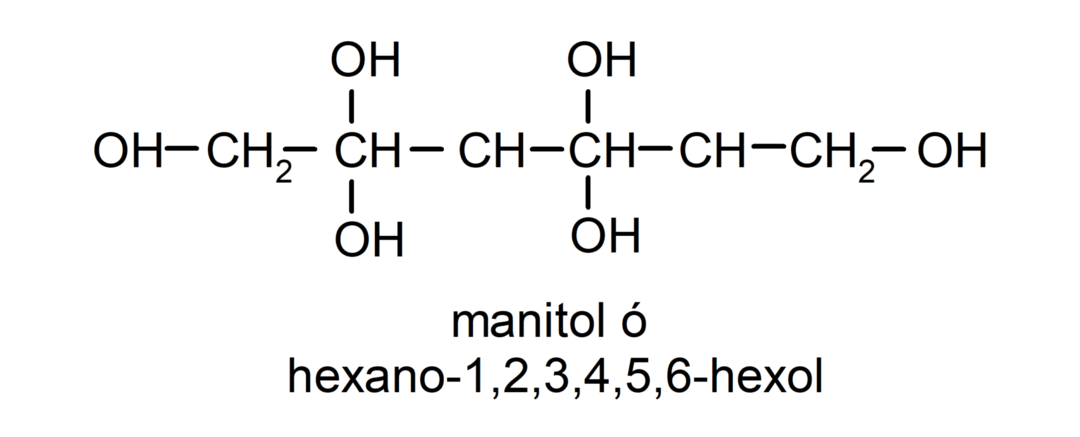
Fizikalna svojstva alkohola
Neka od fizičkih svojstava alkohola su:
- Vrelište. Vrelište u alkoholima je dosta visoko zbog prisutnosti hidroksilne skupine, koja omogućuje stvaranje vodikovih veza. Nadalje, što je više hidroksilnih funkcionalnih skupina prisutno u ugljikovom lancu, to je viši Vrelište od alkohola.
- Polaritet. Alkoholi su prilično polarni spojevi.
- Topljivost. Niskomolekularni alkoholi topljivi su u vodi. S druge strane, što je veći ugljikov lanac alkohola, to je manja njihova topljivost u vodi. Dodatno, što alkoholi imaju više hidroksilnih skupina, veća je njihova topljivost u vodi.
- Agregatno stanje. Većina alkohola je tekuća na sobnoj temperaturi (25ºC) i ima karakteristične mirise.
Kemijska svojstva alkohola
Neka od kemijskih svojstava alkohola su:
- Alkoholi se ponašaju kao kiseline i baze.. Njihovo ponašanje kao kiselina može se vidjeti u reakcijama s aktivnim metalima pri čemu se oslobađa vodikov plin i stvaraju alkoksidi.

Njihovo ponašanje kao baza može se vidjeti u reakcijama kao što je reakcija metanola s bromovodikom da nastane metiloksonijev bromid.
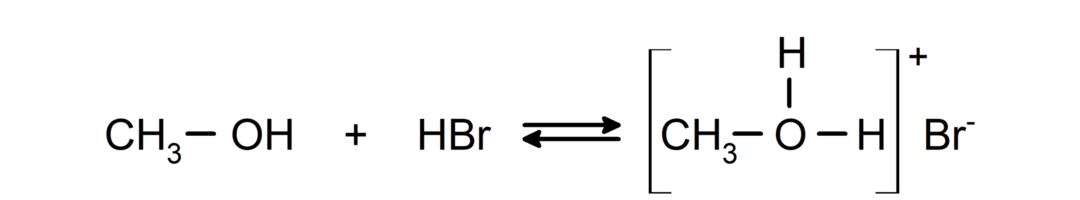
- Alkoholi prolaze kroz reakcije halogeniranja. Reagiraju s vodikovim halidima i stvaraju alkil halogenide.
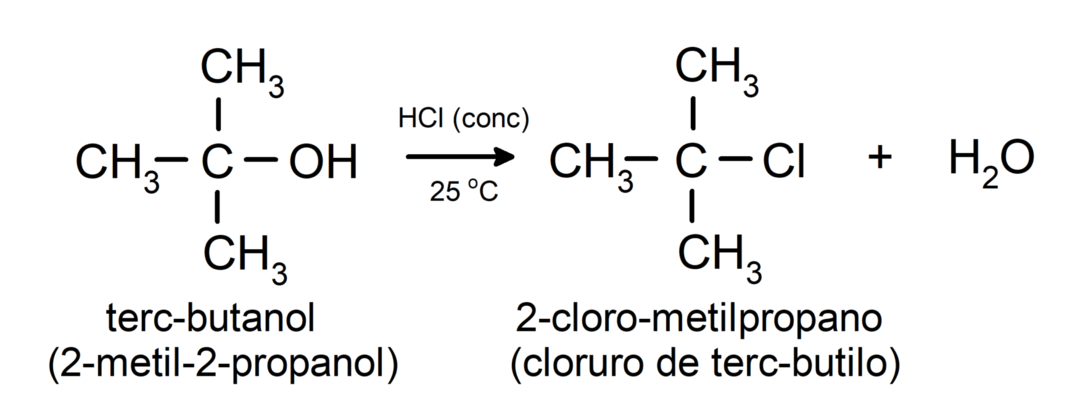
-
Alkoholi prolaze kroz reakcije oksidacije kada reagiraju s određenim oksidirajućim spojevima. Produkti oksidacijskih reakcija ovise o vrsti alkohola koji reagira, odnosno je li primarni, sekundarni ili tercijarni.
Oksidacija primarnog alkohola u aldehid ili karboksilnu kiselinu.
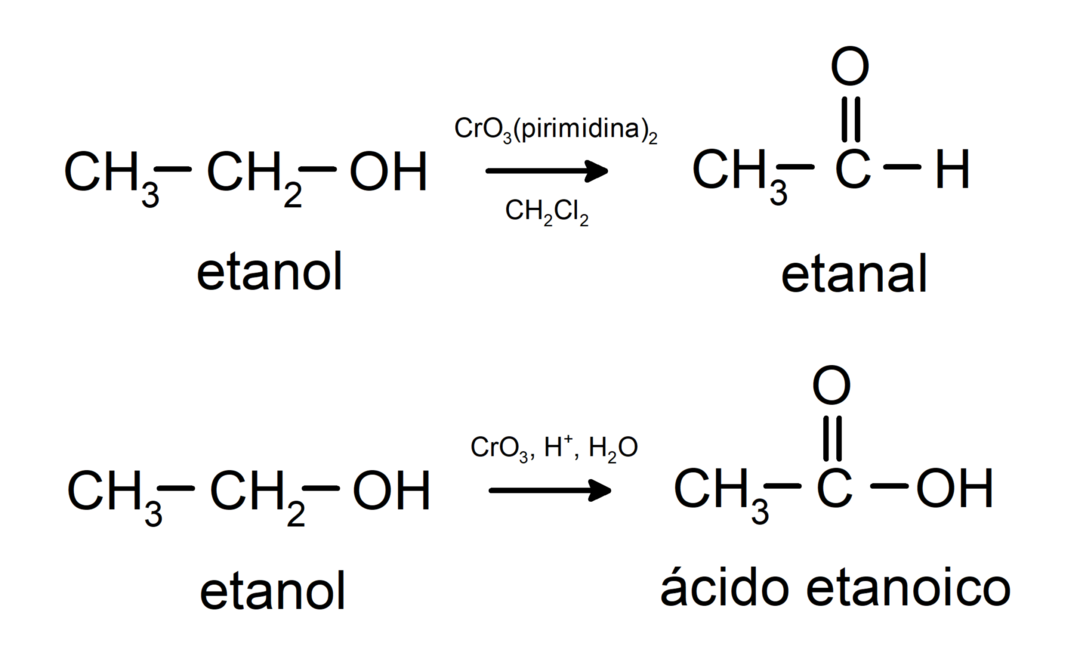
Oksidacija sekundarnog alkohola u keton.
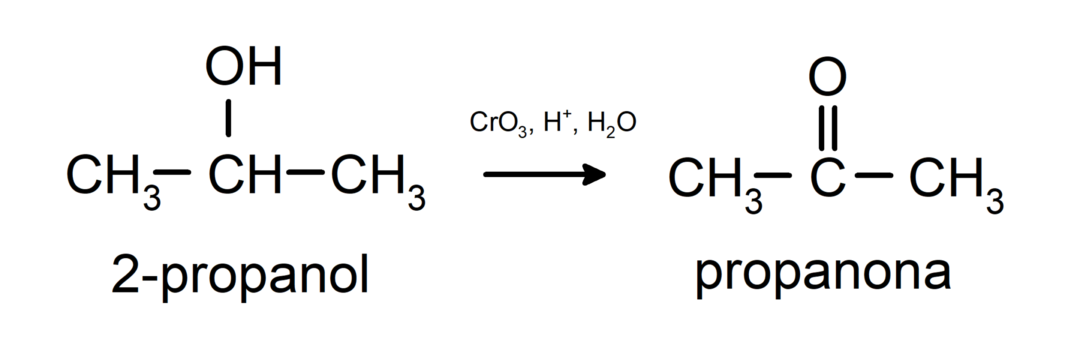
Tercijarni alkoholi ne oksidiraju uobičajenim oksidansima. S vrlo jakim oksidacijskim sredstvima mogu se pretvoriti u alkene, koji se zatim mogu oksidirati.
Alkoholi koji imaju dvije hidroksilne skupine smještene na susjednim ugljicima oksidiraju se olovnim tetraacetatom u dva ketona.
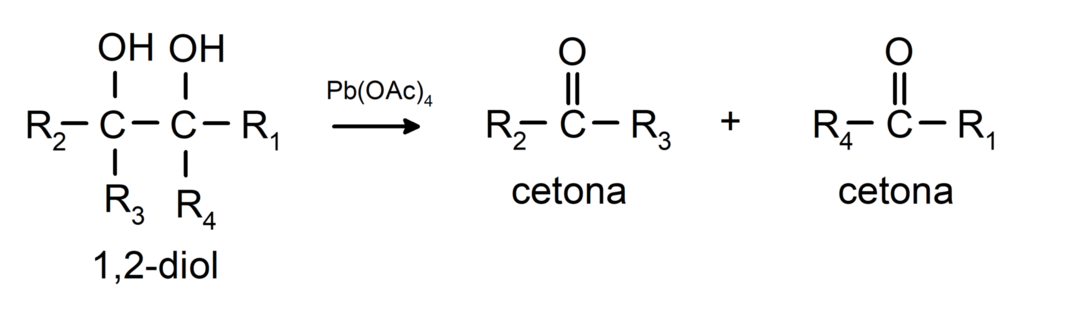
- Alkoholi prolaze kroz reakcije dehidrogenacije. Ove se reakcije odvijaju samo s primarnim i sekundarnim alkoholima, koji kada su podvrgnuti visokim temperaturama u prisutnosti katalizatora, oslobađaju vodike.
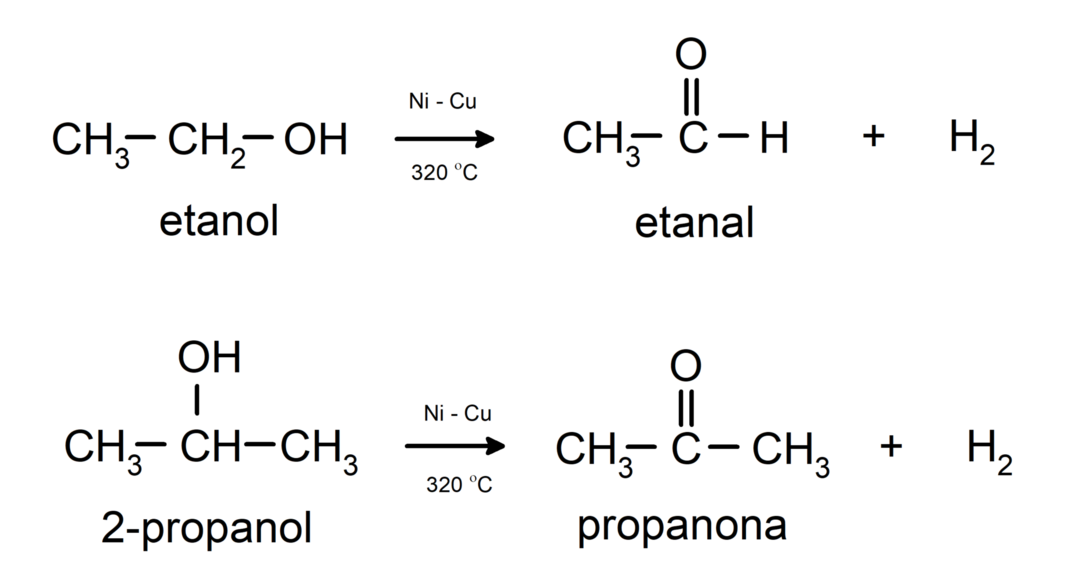
- Alkoholi su podložni reakcijama dehidracije. Alkoholi dehidriraju pri čemu nastaju odgovarajući alkeni. Ova reakcija se odvija u prisutnosti kiseline i srednjih temperatura.
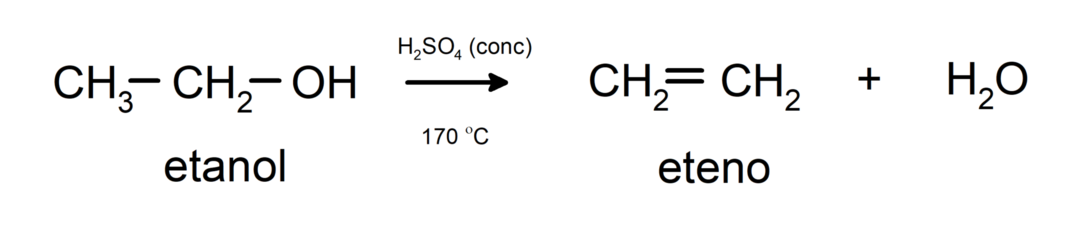
Alkoholna nomenklatura
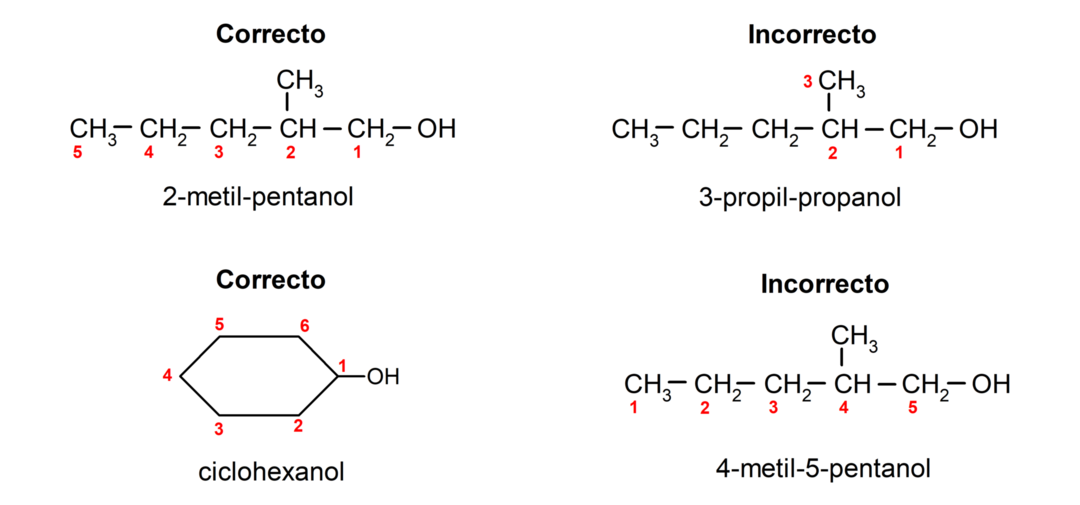
Prema nomenklaturi koju je uspostavio IUPAC (International Union of Pure and Applied Chemistry), alkoholi se imenuju prema sljedećim pravilima:
- Položaj hidroksilne skupine odabire se uzimajući u obzir da ona zauzima najmanji mogući broj u ugljikovom lancu. Ako je struktura alkohola ciklička, uzima se u obzir položaj 1 na ugljiku koji ima spojenu hidroksilnu skupinu i za njegovo imenovanje koristi se prefiks ciklo-.
- Naziv alkohola piše se prefiksima koji označavaju broj atoma u ugljikovom lancu, a dodatno se stavlja sufiks -ol.
- Ako struktura alkohola ima grane, najduži lanac koji također sadrži hidroksilnu skupinu odabire se kao glavni ugljikov lanac.
Prema tradicionalnoj nomenklaturi, alkoholi se imenuju tako da se napiše riječ "alkohol", a zatim se ispiše naziv alkohola. alkana koji odgovara ugljikovom lancu, ali umjesto -an završetka alkana, -ilički.
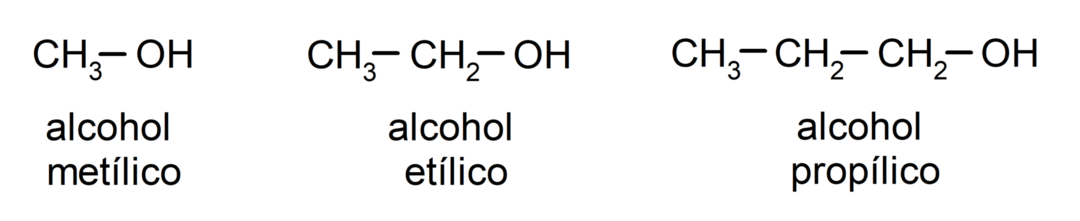
Primjeri alkohola
- metanol
- etanol
- 1-propanol
- 2-propanol
- 1-butanol
- 3-etilheksan-2-ol
- glicerol
- fenol
- 2-metil-2-butanol
- 1,2-etandiol
- 1,5-heptadien-3-ol
- 3-metil-2-butanol
- benzilmetanol
- 3-pentanol
- 2-metilfenol
- 1,2-dihidroksifenol
- cikloheaknol
- 1-feniletanol


Upotreba alkohola
Najčešće upotrebe alkohola su:
- Koriste se kao dezinficijensi i antiseptici jer zaustavljaju rast nekih mikroorganizama ili ih uništiti. U tu svrhu najviše se koriste etanol i izopropilni alkohol.
- Koriste se u sintezi različitih kemijski spojevi. Metanol se, primjerice, koristi za dobivanje metanala (formaldehida).
- Koriste se za proizvodnju antifriza. Metanol je jedan od najčešće korištenih u tu svrhu.
- Koriste se kao otapala u farmaceutskoj industriji. Etanol je jedan od najčešće korištenih u tom smislu.
- Koriste se kao otapala za lakove, boje i tinte. Metanol se široko koristi u tu svrhu.
- Koriste se kao gorivo i postoji važna tendencija njihove djelomične zamjene fosilna goriva korištenjem goriva bioetanola.
- Koriste se za izradu smola. U tom smislu koristi se fenol.
Opasnosti konzumiranja alkohola
Iako je konzumacija alkohola danas društveno prihvaćena, zlouporaba ove supstance stvara ovisnost i ovisnost.
Etanol je alkohol prisutan u alkoholnim pićima, koji kada se konzumira u prekomjernim količinama utječe kognitivne sposobnosti, a može uzrokovati kardiovaskularne bolesti, cirozu jetre i Rak.
Nadalje, kada se postigne stupanj alkoholiziranosti, odnosno stanje pijanstva, ako je doza alkohola previše, može doći do alkoholne kome, što može dovesti do respiratorne paralize, pa čak i smrti. smrt.
Reference
- T. DO. Geissman. (1974.) “Principi organske kemije” drugo izdanje. Uredništvo Reverté, S.A. ISBN: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E. i Valdez-Montero, C. (2017). Konzumacija alkohola kao javnozdravstveni problem. Ra Ximhai, 13(2), 13-24.
- Morrison, R. T. i Boyd, R. N. (1998). Organska kemija. Pearson obrazovanje.
- Weininger, S. J. i Stermitz, F. R. (1988). Organska kemija. Okrenula sam se.
Slijedite s:
- Etil alkohol
- Goriva
- organska kemija



