20 Példák az alkánokra
Vegyes Cikkek / / July 04, 2021
A alkánok egyfajta szénhidrogének amelyben változó számú szénatom van összekötve egyetlen kötéssel, mint egy csontváz, és az egyes szénatomok viszont hidrogénatomokhoz kapcsolódnak, amelyeket végül másokkal helyettesíthetnek atomok vagy funkcionális csoportok. Például: kloroform, metán, oktán.
A molekulaképlet a nyitott lineáris láncú alkánok közül CnH2n + 2ahol C jelentése szénatom, H jelentése hidrogénatom és n a szénatomok számát jelenti. Az alkánok telített szénhidrogének, ami azt jelenti, hogy nincsenek kettős vagy hármas kötéseik. Megnevezésükhöz használja a utótag "-Ano", miután megnevezte a szénláncot a előtag amely megfelel a szénatomok számának (et- (2), pro- (3), but- (4), pen- (5), hex- (6), hep- (7) stb.).
Ez szolgálhat Önnek:
Az alkánok osztályozása
Az alkánokon belül általában felismerik őket két nagy csoport: nyitott lánc (más néven aciklikus) és zárt lánc (vagy ciklikus).
Amikor az nyílt láncú vegyületek Nem mutatnak szubsztitúciót az egyes szénatomokat kísérő hidrogéneknél, lineáris alkánoknak nevezzük őket: ezek a legegyszerűbb alkánok. Amikor bármelyik hidrogénatomjukat egy vagy több szénlánccal helyettesítik, elágazó szénláncú alkánoknak nevezik őket. A leggyakoribb szubsztituensek az etilcsoportok (CH
3CH2-) és metil (CH3-).A maguk részéről vannak olyan vegyületek, amelyek egyetlen ciklusúak a molekulában (monociklusosak), mások pedig több ciklusúak (policiklusosak). A ciklikus alkánok lehetnek homociklusosak (a szénatomok kizárólagos beavatkozásával jönnek létre) vagy heterociklusos csoportok (amelyekben más atomok vesznek részt, például oxigén vagy kén).
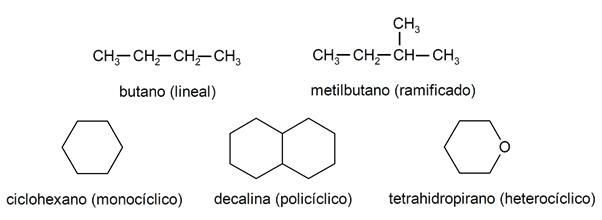
Az alkánok fizikai tulajdonságai
Általánosságban, fizikai tulajdonságok Az alkánok molekulatömege kondicionált (viszont a szénlánc hosszához kapcsolódik). A legalacsonyabb szénatomszámúak gáznemű nak nek hőfok 5-18 szénatomot tartalmazóak folyadékok, és e szám felett vannak szilárd (hasonló a viaszhoz).
Mivel kevésbé sűrű, mint a víz, hajlamosak lebegni rajta. Az alkánok általában vízben nem oldódnak és szerves oldószerekben oldódnak.
A lényeg forró és a fúzió az alkánok mennyisége attól függ molekulatömeg, vagyis a szénlánc hosszától, bár sokszor függenek az atomok térbeli elrendezésétől is. A lineáris és ciklikus alkánok forráspontja magasabb, mint az elágazó szénláncúaké.
Az alkánok kémiai tulajdonságai
Az alkánokat a lét jellemzi kémiai vegyületek a nagyon gyenge reaktivitás, ezért "parafineknak" is nevezik (latinul, parum affinis jelentése "alacsony affinitás"). Ezek olyan vegyületek, amelyek nagyon magas aktivációs energiával rendelkeznek, amikor részt vesznek benne kémiai reakciók. Az alkánok legfontosabb reakciója az égés oxigén, hő, szén-dioxid és víz jelenlétében keletkezik.
Az alkánok jelentik a velük kapcsolatos reakciók fontos változatosságát ipari folyamatok nagyon fontos, mivel ezek a leghagyományosabb üzemanyagok. Olyan biológiai folyamatok végtermékeiként is megjelennek, mint például egyesek által végzett metanogén fermentáció mikroorganizmusok.
Példák alkánokra
Néhány példa az alkánokra (köztük néhány jól ismert lineáris és elágazó láncú):
- Kloroform (a képzelet neve triklór-metán; CHCl3). Ennek az anyagnak a gőzeit használták érzéstelenítőként. Erre a célra megszüntették, mert kiderült, hogy károsodott szervek fontosak, például a máj vagy a vesék. Napjainkban elsősorban oldószerként vagy hűtőfolyadékként használják.
- Metán (CH4). Ez az összes közül a legegyszerűbb alkán: csak egy szénatomból és négy hidrogénatomból áll. Ez egy olyan gáz, amely természetes módon különböző szerves szubsztrátok bomlásával fordul elő, és amely a földgáz fő alkotóeleme. A közelmúltban az egyik olyan gázként ismerik el, amely leginkább hozzájárul az úgynevezett üvegházhatáshoz.
- Oktán (C8H18). Ez a nyolcszénes alkán, és nagy jelentőségű, mivel meghatározza a benzin végső minőségét, amely egy keverd össze különböző szénhidrogének. Ezt a minőséget az üzemanyag oktánszámával vagy oktánszámával mérjük, amely referenciaként egy alacsony detonálást (100 index) és egy erősen detonáló (0 index) értéket vesz fel.
- Hexán (C6H14). Fontos oldószer, belélegzését kerülni kell, mivel nagyon mérgező.
- Bután (C4H10). Propánnal (C3H8) alkotják az úgynevezett cseppfolyósított kőolajgázokat (LPG), amelyek az olajkitermelés során gáztáskákban képződnek. Jelenleg a benzin vagy a gázolaj üzemanyagként történő LPG-vel történő cseréjét támogatják, mivel az már létezik környezetbarátabb szénhidrogén (égése során csak szén-dioxidot és vizet bocsát ki).
- Icosano (C20H42). Ez a húsz szénatomos alkán (az „ico” előtag húszat jelent)
- Ciklopropán (C3H6). Korábban érzéstelenítőként használták
- n-heptán (C7H16). Ez az, amelyet referenciaként veszünk a benzin oktánskálájának nulla pontjára, ami a legkevésbé kívánatos lenne, mivel robbanásszerűen ég. Bizonyos anyagok gyantájából nyerik növények.
- 3-etil-2,3-dimetil-pentán (C9H20)
- 2-metil-bután (C5H12)
- 3-klór-4-n-propil-heptán (C10H21Cl)
- 3,4,6-trimetil-heptán (C10H22)
- 1-bróm-2-fenil-etán (C8H9Br)
- 3-etil-4-metil-hexán (C9H18)
- 5-izopropil-3-metil-nonán (C13H28)
- kubai (C8H8)
- 1-bróm-propán (C3H7Br)
- 3-metil-5-n-propil-oktán (C12H26)
- 5-n-butil-4,7-dietil-dekán (C18H28)
- 3,3-dimetil-dekán (C12H26)

