30 Példák alkoholokra
Példák / / November 06, 2023
A alkoholok vannak szerves kémiai vegyületek amelyek szerkezetükben egy szénhez (-C) kapcsolódó hidroxil funkciós csoportot (-OH) tartalmaznak. A csoportot (-C – OH) „karbinolnak” nevezik. Néhány példa az alkoholokra: metanol, etanol és 1-propanol.
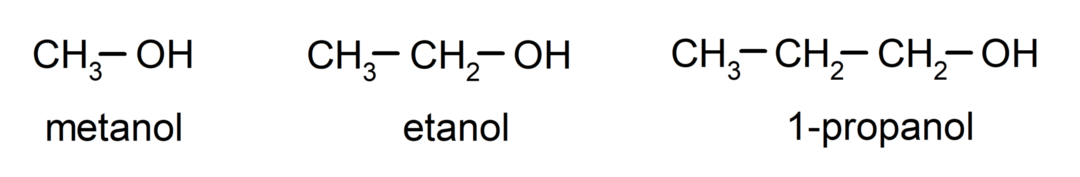
Az alkoholok a mindennapi életben különféle felhasználású kémiai vegyületek, mivel antibakteriális és fertőtlenítő tulajdonságokkal rendelkeznek. Másrészt ellenőrizetlen lenyelésük esetén veszélyesek lehetnek az emberi egészségre.
Hasonlóképpen, nem minden alkoholt tud lenyelni az ember.
- Lásd még: Aminok és ketonok
Az alkoholok fajtái
Attól függően, hogy hány szénatomhoz kapcsolódik a hidroxilcsoportot tartalmazó szénatom, az alkohol lehet:
- Elsődleges alkohol. Az a szénatom, amelyhez a hidroxilcsoport kapcsolódik, szintén egyetlen szénatomhoz kapcsolódik. Például:
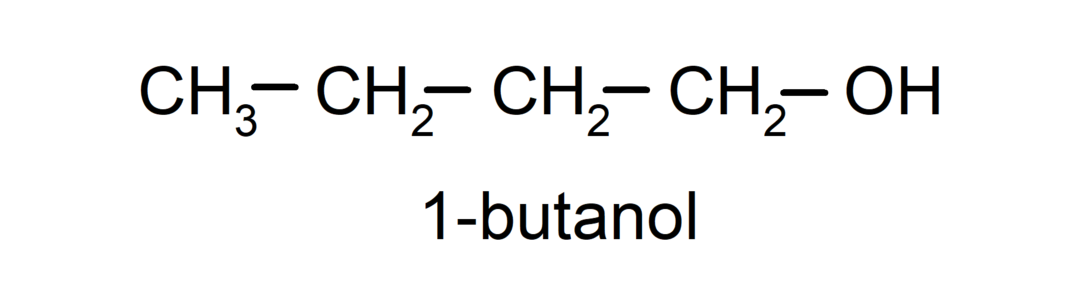
- Másodlagos alkohol. Az a szénatom, amelyhez a hidroxilcsoport kapcsolódik, két másik szénatomhoz is kapcsolódik. Például:
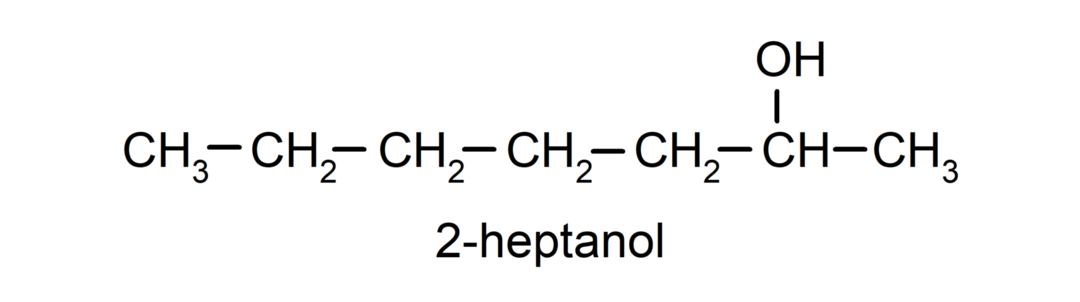
- Tercier alkohol. Az a szénatom, amelyhez a hidroxilcsoport kapcsolódik, szintén három szénatomhoz kapcsolódik. Például:
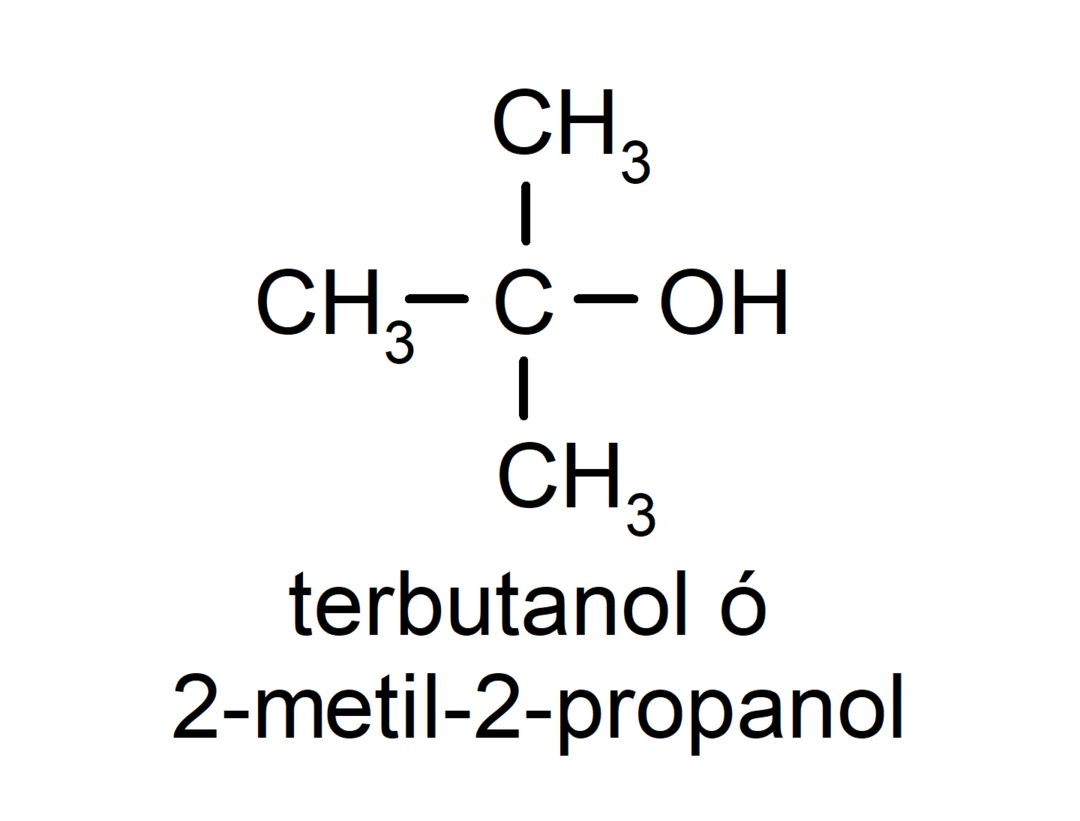
A hidroxilcsoportok számától függően egy alkohol lehet:
- Diol. Szerkezetében két hidroxilcsoport van. Például:
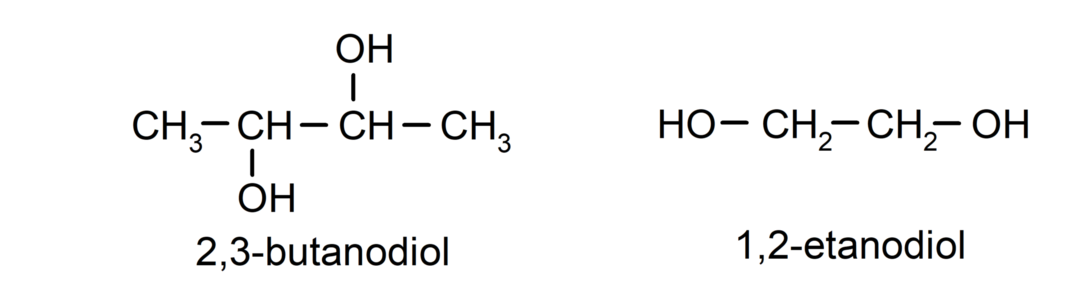
- Triol. Szerkezetében három hidroxilcsoport van. Például:
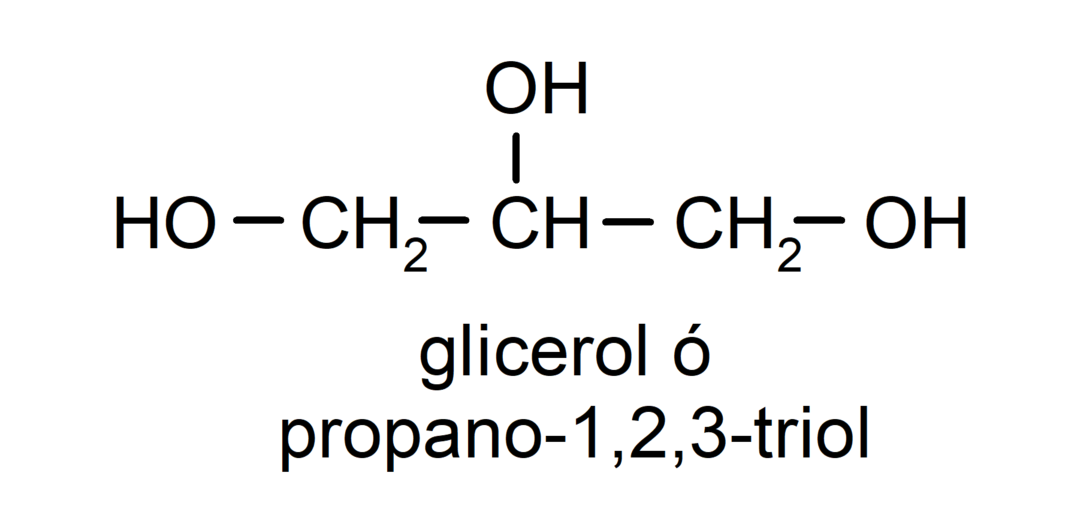
- Polialkohol. Szerkezetében sok hidroxilcsoport van. Például:
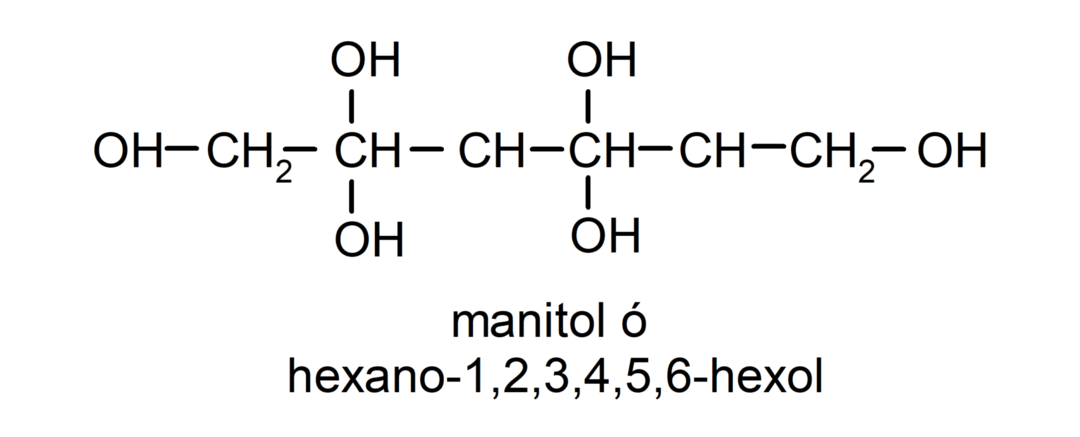
Az alkoholok fizikai tulajdonságai
Az alkoholok néhány fizikai tulajdonsága:
- Forráspont. Az alkoholok forráspontja meglehetősen magas a hidroxilcsoport jelenléte miatt, amely lehetővé teszi a hidrogénkötések kialakulását. Továbbá minél több hidroxil funkciós csoport van jelen a szénláncban, annál magasabb a Forráspont alkoholok.
- Polaritás. Az alkoholok meglehetősen poláris vegyületek.
- Oldhatóság. Az alacsony molekulatömegű alkoholok vízben oldódnak. Másrészt minél nagyobb az alkoholok szénlánca, annál kisebb az oldhatóságuk vízben. Ezenkívül minél több hidroxilcsoport van az alkoholokban, annál jobban oldódnak vízben.
- Az összesítés állapota. A legtöbb alkohol szobahőmérsékleten (25 °C) folyékony, és jellegzetes szagú.
Az alkoholok kémiai tulajdonságai
Az alkoholok kémiai tulajdonságai közül néhány:
- Az alkoholok savaként és bázisként viselkednek.. Savként való viselkedésük megfigyelhető az aktív fémekkel való reakciókban, amelyek során hidrogéngáz szabadul fel és alkoxidok képződnek.

Bázisként való viselkedésük olyan reakciókban is megfigyelhető, mint a metanol és a hidrogén-bromid reakciója metiloxónium-bromid képződéséhez.
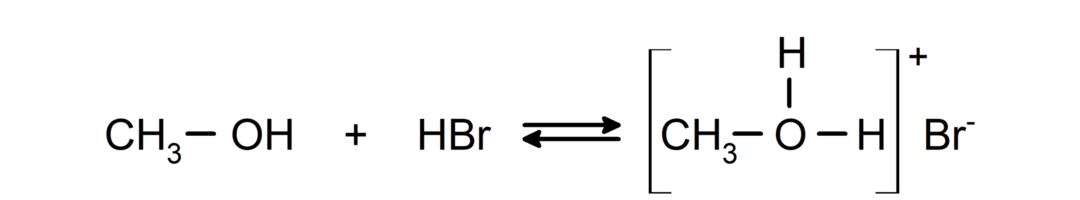
- Az alkoholok halogénezési reakciókon mennek keresztül. Hidrogén-halogenidekkel reagálva alkil-halogenideket képeznek.
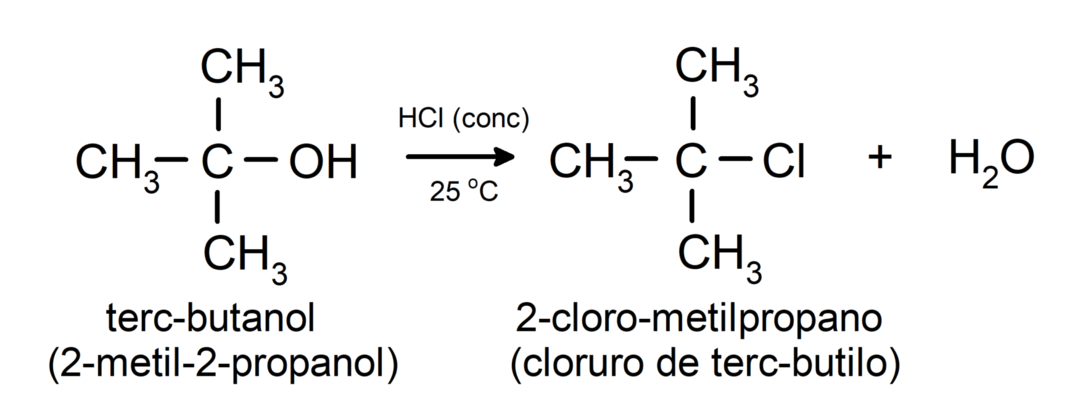
-
Az alkoholok oxidációs reakciókon mennek keresztül amikor reakcióba lépnek bizonyos oxidáló vegyületekkel. Az oxidációs reakciók termékei a reagáló alkohol típusától függenek, vagyis attól, hogy az primer, szekunder vagy tercier alkohol.
Primer alkohol oxidációja aldehiddé vagy karbonsavvá.
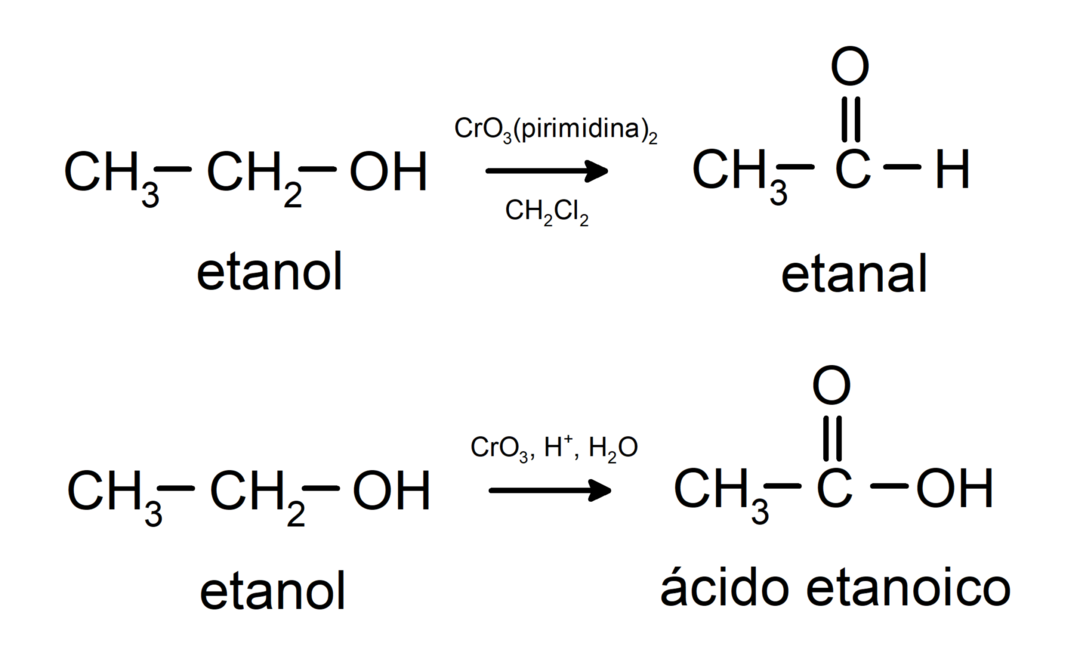
Másodlagos alkohol oxidációja ketonokká.
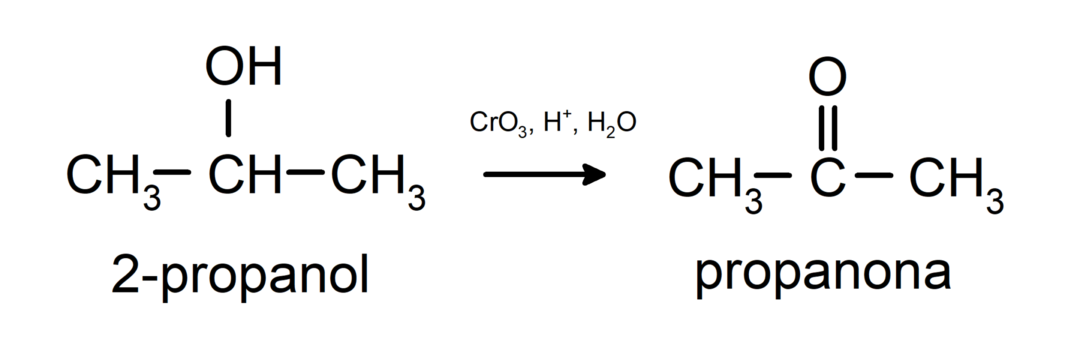
A tercier alkoholok nem oxidálódnak a szokásos oxidálószerekkel. Nagyon erős oxidálószerekkel alkénekké alakíthatók, amelyek aztán oxidálhatók.
Azokat az alkoholokat, amelyekben két hidroxilcsoport található a szomszédos szénatomokon, ólom-tetraacetáttal oxidálják, így két keton keletkezik.
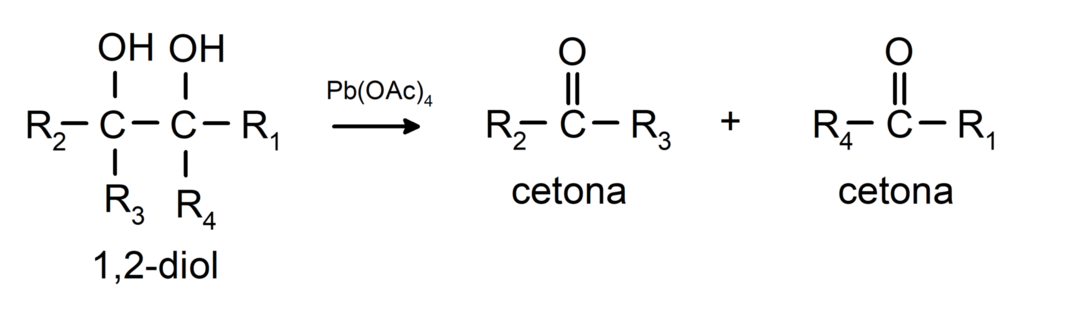
- Az alkoholok dehidrogénezési reakciókon mennek keresztül. Ezek a reakciók csak primer és szekunder alkoholokkal mennek végbe, amelyek katalizátor jelenlétében magas hőmérsékletnek kitéve hidrogént szabadítanak fel.
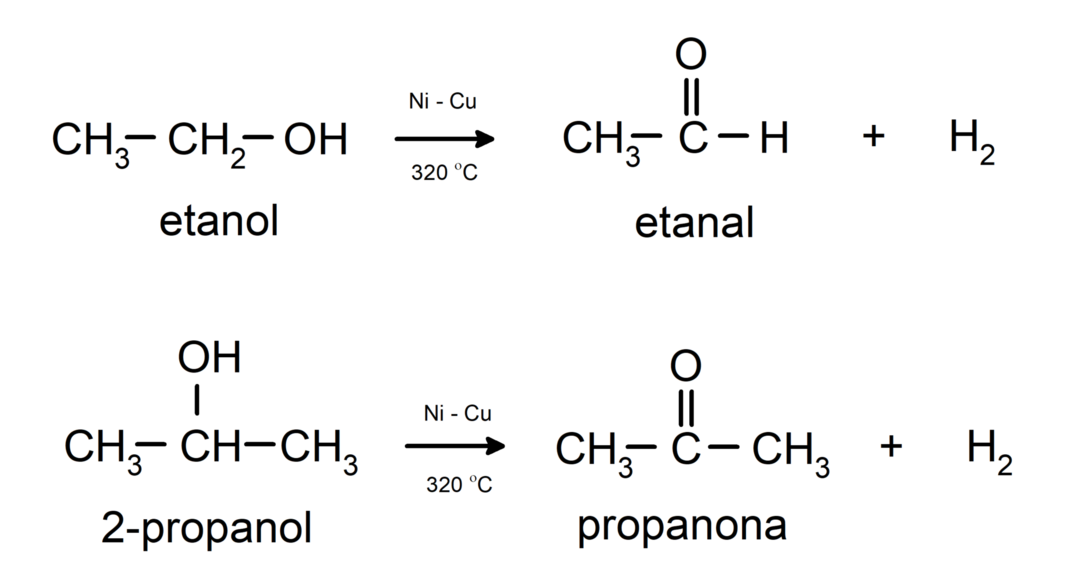
- Az alkoholok dehidratációs reakciókon mennek keresztül. Az alkoholok dehidratálódnak és a megfelelő alkének keletkeznek. Ez a reakció sav jelenlétében és közbenső hőmérsékleten megy végbe.
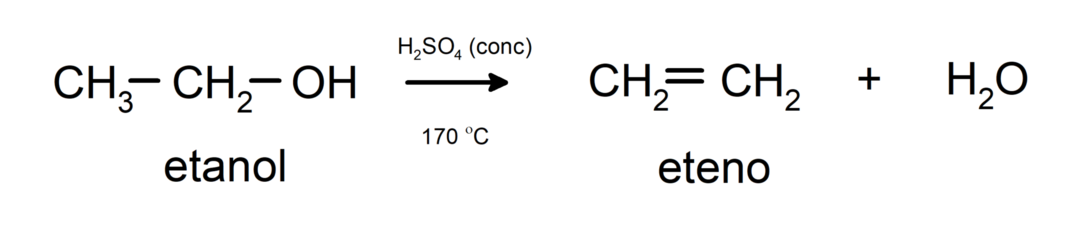
Alkohol nómenklatúra
Az IUPAC (International Union of Pure and Applied Chemistry) által létrehozott nómenklatúra szerint az alkoholokat a következő szabályok szerint nevezik el:
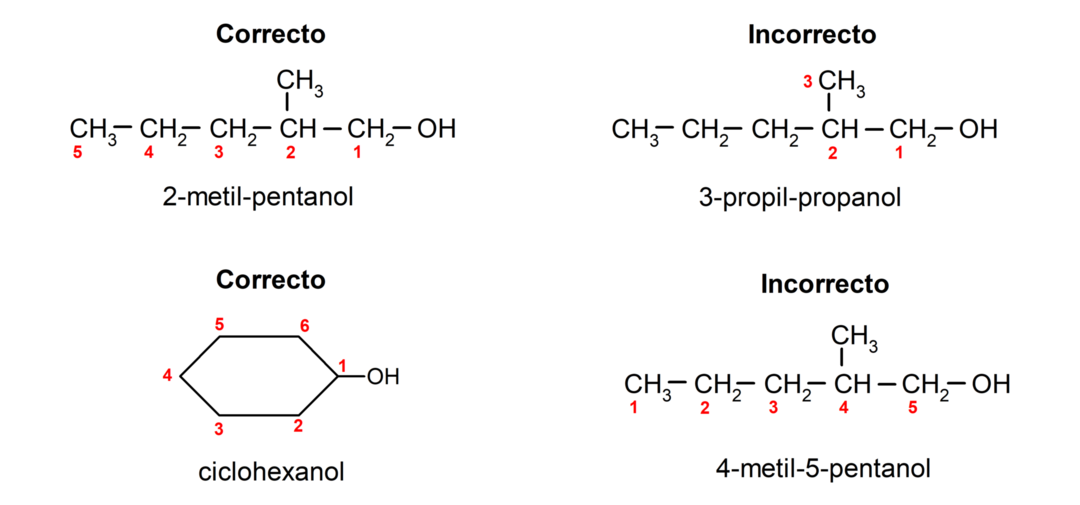
- A hidroxilcsoport helyzetét úgy választjuk meg, hogy a szénláncban a lehető legalacsonyabb helyet foglalja el. Ha az alkohol szerkezete ciklikus, akkor a szénatomon a hidroxilcsoportot tartalmazó 1-es pozíciót veszik figyelembe, és a ciklo- előtagot használják ennek elnevezésére.
- Az alkohol nevét olyan előtagokkal írják fel, amelyek a szénlánc atomjainak számát jelzik, és ezen kívül az -ol utótagot is elhelyezik.
- Ha az alkohol szerkezete elágazásokat tartalmaz, akkor fő szénláncnak a leghosszabb láncot választjuk, amely a hidroxilcsoportot is tartalmazza.
A hagyományos nómenklatúra szerint az alkoholokat az „alkohol” szó beírásával, majd az alkohol nevének beírásával nevezik el. a szénláncnak megfelelő alkánt, de az alkán -án végződés helyett a végződést -illikus.
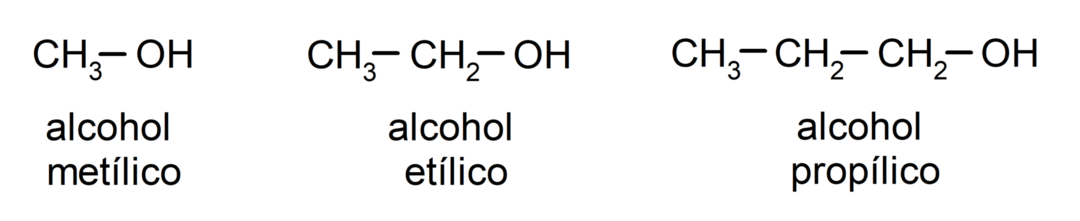
Példák az alkoholokra
- metanol
- etanol
- 1-propanol
- 2-propanol
- 1-butanol
- 3-etil-hexán-2-ol
- glicerin
- fenol
- 2-metil-2-butanol
- 1,2-etándiol
- 1,5-heptadien-3-ol
- 3-metil-2-butanol
- benzil-metanol
- 3-pentanol
- 2-metil-fenol
- 1,2-dihidroxi-fenol
- cikloheaxnol
- 1-fenil-etanol


Az alkoholok felhasználása
Az alkoholok leggyakoribb felhasználási területei:
- Fertőtlenítőszerként és antiszeptikumként használják, mivel megállítják egyesek növekedését mikroorganizmusok vagy elpusztítani őket. Erre a célra leginkább az etanolt és az izopropil-alkoholt használják.
- Különböző anyagok szintézisében használják őket kémiai vegyületek. Metanolt például metanol (formaldehid) előállítására használnak.
- Fagyálló előállítására használják őket. A metanol az egyik leggyakrabban használt ilyen célra.
- Oldószerként használják a gyógyszeriparban. Az etanol ebben az értelemben az egyik leggyakrabban használt.
- Oldószerként használják lakkokhoz, festékekhez és tintákhoz. A metanolt széles körben használják erre a célra.
- Tüzelőanyagként használják őket, és fontos tendencia, hogy részben felváltják a felhasználást fosszilis tüzelőanyagok bioetanol üzemanyag használatával.
- Gyanták készítésére használják őket. A fenolt ebben az értelemben használjuk.
Az alkoholfogyasztás veszélyei
Bár az alkoholfogyasztás ma társadalmilag elfogadott, az ezzel a szerrel való visszaélés függőséget és függőséget generál.
Az etanol az alkoholtartalmú italokban található alkohol, amely túlzott fogyasztása befolyásolja kognitív képességeit, valamint szív- és érrendszeri betegségeket, májzsugort és rák.
Továbbá az alkoholmérgezés mértékének, azaz az ittas állapot elérésekor, ha a túl magas az alkoholszint, alkoholos kóma léphet fel, ami légzésbénuláshoz és akár halálhoz is vezethet. halál.
Hivatkozások
- T. NAK NEK. Geissman. (1974) „A szerves kémia alapelvei” második kiadás. Editorial Reverté, S.A. ISBN: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E. és Valdez-Montero, C. (2017). Az alkoholfogyasztás mint népegészségügyi probléma. Ra Ximhai, 13(2), 13-24.
- Morrison, R. T. és Boyd, R. N. (1998). Szerves kémia. Pearson oktatás.
- Weininger, S. J. és Stermitz, F. R. (1988). Szerves kémia. megfordítottam.
Kövesse a következővel:
- Etilalkohol
- Üzemanyagok
- szerves kémia
