Példa aromás vegyületekre
Kémia / / July 04, 2021
A kémikusok hasznosnak találták az összes szerves vegyület két nagy osztályba sorolását: vegyületek Alifás és vegyületek Aromatikák. Az aromás vegyületek a benzol és a hasonló kémiai viselkedésű vegyületek. Az aromás tulajdonságok különböztetik meg a benzolt az alifás szénhidrogénektől. A benzolmolekula egy bizonyos típusú gyűrű. Vannak más, szintén gyűrű alakú vegyületek, amelyek szerkezetileg különböznek a benzoltól, és mégis hasonló módon viselkednek.
Kiderült, hogy ezek a további vegyületek alapvető elektronikus felépítésükben hasonlítanak a benzolra, ezért aromás anyagként is viselkednek.
Az alifás szénhidrogének (alkánok, alkének, alkinek és ciklikus analógjaik) főként a következőkkel reagálnak kiegészítés, több linkben és by szabad gyökök helyettesítése, az alifás lánc más pontjain.
Másrészt az aromás szénhidrogének hangsúlyozzák, hogy hajlamosak arra heterolitikus szubsztitúció. Ezenfelül ugyanazok a szubsztitúciós reakciók jellemzők az aromás gyűrűkre, bárhol is jelennek meg, függetlenül attól, hogy a molekula milyen más funkciós csoportokat tartalmazhat. Ez utóbbi csoportok befolyásolják az aromás gyűrűk reakcióképességét, és fordítva.
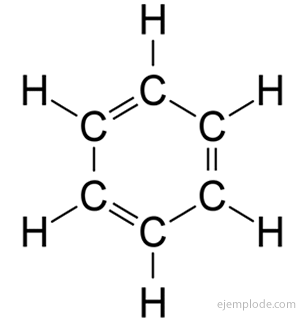
A benzol molekula
A benzolt 1825 óta ismerik, kémiai és fizikai tulajdonságai jobban ismertek, mint bármely más szerves vegyületé. Ennek ellenére csak 1931-ben javasoltak erre kielégítő struktúrát 15 évbe telt, mire általánosan használt volt a Chemicals között organikus. A nehézség abban rejlett, hogy a struktúraelmélet addigra elérte a fejlődést. A végső struktúrát számos fontos tény feltételezésének köszönhetően sikerült elérni:
A benzol molekuláris képlete C6H6. Elemi összetételének és molekulatömegének köszönhetően a benzolnak hat szén- és hat hidrogénatomja volt. A probléma az ilyen atomok elrendezésének ismerete volt.
1858-ban August Kekulé azt javasolta, hogy a szénatomok összekapcsolódjanak és láncokat alkossanak. Később, 1865-ben felajánlotta a választ a benzol problémájára: ezek a karbonátláncok néha lezárhatók, gyűrűt alkothatnak.
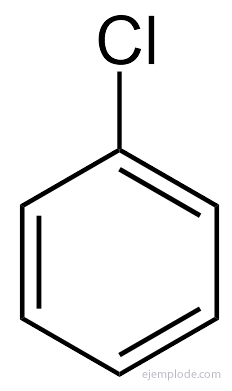
A benzol csak egyszeresen helyettesített C terméket eredményez6H5Y. Például, ha a hidrogénatomot brómra cseréljük, csak a bróm-benzol C konfigurációját kapjuk.6H5Br; analóg módon egy klórbenzolt is kapunk6H5Cl, vagy nitrobenzol C6H5NEM2stb. Ez a tény komoly korlátokat szab a benzol szerkezetére: az összes hidrogénének meg kell lennie pontosan ekvivalens, vagyis mindegyiket össze kell kapcsolni a szénhidrogénekkel, amelyek viszont mind egyformán összekapcsolva. CH-ben nem lehetnek hidrogének3és mások CH-ban2és mások CH-ban. A monoszubsztituált végső szerkezetének meg kell egyeznie a benzolban lévő bármely hidrogén helyettesítésével.
A benzol három izomer diszubsztituált terméket, C6H4Y2 vagy C6H4ÉS Z. Csak három izomer DiBromoBenzol, C6H4Br2, három klór-nitrobenzol C6H4ClNO2stb. Ez a tény tovább korlátozza a strukturális lehetőségeket.
A benzol szubsztitúciós reakciókon megy keresztül, nem pedig addíciós reakciókon. A Kekulé benzolszerkezete megfelel annak, amelyet ciklohexatriénnek neveznénk. Emiatt könnyen reagálnia kell hozzáadással, csakúgy, mint a hasonló vegyületek, a ciklohexadién és a ciklohexén, amely az alkének szerkezetére jellemző. De ez nem így van; olyan körülmények között, ahol az alkének gyorsan reagálnak, a benzol nem, vagy csak nagyon lassan reagál. Az addíciós reakciók helyett a benzol könnyen átesik egy sor reakcióban, amelyek mindegyike megtörténik helyettesítés, mint a Nitrálás, a Szulfonálás, a Halogénezés, a Friedel-Crafts alkilezés, a Acilezés tól től Friedel-Crafts. Ezen reakciók mindegyikében egy atom vagy csoport helyébe a benzol egyik hidrogénatomja lépett.
A benzol stabilitása a váltakozó kettős kötéseknek és a rezonancia energiának köszönhető az, amelyben a kettős kötések megváltoztatják helyzetüket a szénatomok között, ugyanazon váltakozást fenntartva szerkezeti. Is rezonancia stabilizációs energia az úgynevezett tulajdonságokért felelős Aromás tulajdonságok.
Egy addíciós reakcióval az alkén stabilabb telített vegyületté alakul. De a benzol esetében egy kiegészítés kevésbé stabilá teszi, ha elpusztítja a rezonancia által fenntartott és stabilizált gyűrűrendszert. A végső molekula a ciklohexadién lenne. Ennek a ténynek köszönhető, hogy a benzol stabilitása csak szubsztitúciós reakciókhoz vezet.
Aromás vegyületek tulajdonságai
A benzolgyűrűket tartalmazó anyagok mellett még sok más tekinthető aromásnak, bár a felszínen alig hasonlítanak a benzollal.
Kísérleti szempontból az aromás vegyületek olyan anyagok, amelyek molekula képlete alapján a nagyfokú telítetlenség, amelyek ellenére vannak ellenálló az addíciós reakciókkal szemben annyira jellemző a telítetlen vegyületekre.
Ehelyett ezek az aromás vegyületek a gyakran elektrofil szubsztitúciós reakciókon mennek keresztül hasonló a benzoléhoz. A hozzáadással szembeni ellenállás mellett, és valószínűleg emiatt, bizonyíték van a szokatlan stabilitás, mint például a hidrogénezés és az égés alacsony hőmérséklete.
Az aromás anyagok ciklikusak, általában öt, hat és hét atomból álló gyűrűket mutatnak be, és fizikai vizsgálatuk azt mutatja, hogy vannak lapos vagy majdnem lapos molekulák. Protonjainak ugyanolyan típusú kémiai eltolódása van a nukleáris mágneses rezonancia spektrumokban, mint a benzolban és származékaiban.
Elméleti szempontból ahhoz, hogy egy anyag aromás legyen, molekulájának ciklikus delokalizált π elektronfelhőkkel kell rendelkeznie a molekula síkja felett és alatt; Ezenkívül ezeknek a π felhőknek összesen (4n + 2) π elektronokat kell tartalmazniuk; ez azt jelenti, hogy a delokalizáció nem elegendő az aromás vegyületre jellemző sajátos stabilitás eléréséhez.
Benzolszármazékok (aromás vegyületek) nomenklatúrája
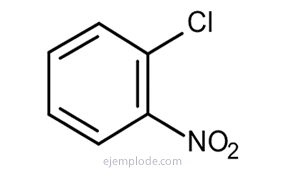
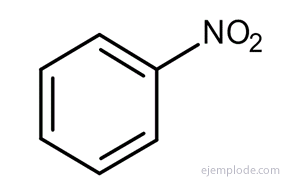
Sok ilyen származék esetében, különösen egyszubsztituáltak esetében, elegendő a a benzol szó helyettesítő csoportja, például klór-benzol, bróm-benzol, jód-benzol, Nitrobenzol.
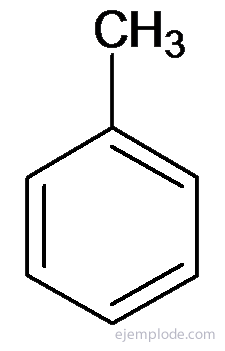
Más származékok speciális nevekkel rendelkeznek, amelyek hiányozhatnak a szubsztituenscsoport nevével. Például a metil-benzolt csak toluolként ismerik; Amino-benzol anilin formájában; Hidroxi-benzol fenolként stb.
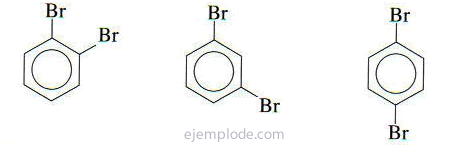
Ha két csoport kapcsolódik a benzolgyűrűhöz, akkor nemcsak annak azonosítására van szükség, hanem relatív elhelyezkedésükről is. A diszubsztituált benzolok három lehetséges izomerjét az orto, meta és para előtagok jellemzik, rövidítve o-, m-, p-. Például: o-DiBromoBenzene, m-DiBromoBenzene, p-DiBromoBenzene.
Ha a két csoport egyike olyan típusú, amely a molekulának különleges nevet ad, akkor a vegyületet az adott speciális anyag származékaként nevezik meg. Például: nitro-toluol, bróm-fenol stb.
Példák aromás vegyületekre
Toluol vagy metilbenzol
Etil-benzol
Izopropil-benzol
TriNitro-toluol vagy TNT
Anilin vagy aminobenzol
Benzoesav
Glutaminsav vagy Para-amino-benzoesav
Toluol-szulfonsav
Fenol vagy hidroxi-benzol
Bróm-fenol
Triklór-benzol
Benzol-fenil-éter
Jód-benzol
Bróm-benzol