Dalton-törvény példája
Kémia / / July 04, 2021
John Dalton (1766-1844) angol tudós fizikus és kémikus volt, aki sokban hozzájárult az elemek és vegyi anyagok összenyomásához és osztályozásához. Legfőbb hozzájárulásai között szerepel az atomok és vegyületek grafikus ábrázolással történő első ábrázolási modellje. Megfogalmazta az úgynevezett "többszörös törvényt", más néven Dalton törvényét.
A kémiai kombinációkról Louis Proust (1754-1826) megfogalmazta az "állandó arányok törvényét", amelyben összegyűjti. az a megfigyelés, hogy a vegyi anyagok mindig azonos arányban keverednek ugyanazon vegyületek előállítására. Vagyis ha a hidrogént és az oxigént egyesítik, akkor mindig azonos arányban egyesülnek, és így vizet termelnek. Ez a törvény azonban nem magyarázta el, hogyan léteznek ugyanazon anyagokból különböző vegyületek.
Atomelméletével Dalton rájött, hogy ha egyes egyszerű anyagokat kombinálnak, akkor képesek rá különböző vegyületek keletkeznek, és hogy az egyik anyag mennyisége arányosan változik egyszerű.
Dalton törvénye így hangzik: Egy elem súlya, amely azonos mennyiségű másikhoz kapcsolódik, és különböző kémiai vegyületeket képez, nagyon egyszerű összefüggés szerint változik.
Ez azt jelenti, hogy ha tudjuk, hogy az anyagok hogyan keverednek egyszerű arányban, és az egyik anyag mennyisége állandó és egy másik marad anyagot egyszerű arányban adjuk meg, 2, 3 vagy 4 arányban az eredeti arányhoz viszonyítva, minden esetben kapunk egy anyagot különböző. Ez történik például a foszfor, a hidrogén és az oxigén kombinálásakor.
Ha 1 térfogat foszfort, 3 térfogat hidrogént és 2 térfogat oxigént egyesítünk, hipofoszforsavat kapunk:
P + 3H + 2O -> PO2H3
Ha az előző reakcióban csak az oxigént változtatjuk 2 egyszerű arányban, akkor foszforsavat kapunk:
P + 3H + 4O -> PO4H3
Figyelembe kell venni, hogy ekkor még nem volt ismert az atom vegyérték fogalma, tehát nem tudni pontosan, hogy egyes anyagokat miért lehet változó arányban kombinálni, másokat miért nem.
Dalton-törvény példája
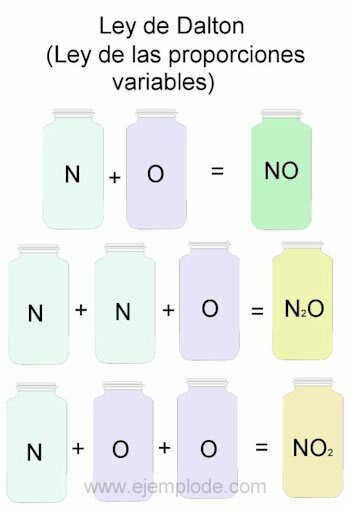
A Dalton-törvény példájaként a nitrogén (N) és az oxigén (O) kombinációit vesszük referenciaként.
Ha azonos arányban, azaz egyesével kombinálják őket, nitrogén-oxidot kapunk:
N + O -> NO
Ha állandó értéken tartjuk a nitrogénmennyiséget és 2-vel változtatjuk az oxigént, nitrogén-peroxidot kapunk:
N + 2O -> NO2
Ha a nitrogén-monoxid alapján most állandóan tartjuk az oxigént, és 2-rel változtatjuk a nitrogén térfogatát, akkor dinitrogén-oxidot kapunk:
2N + O -> N2VAGY
Ha a cikk hasznos volt az Ön számára, ne felejtse el megadni nekünk a +1 értéket.



