Contoh Basa Kimia
Kimia / / November 13, 2021
Dalam Kimia Umum, Basa adalah kategori bahan kimia yang memenuhi beberapa fungsi:
-Bereaksi dengan Asam dalam Netralisasi, menghasilkan Garam dan Air.
-Mengatur Potensi hidrogen, pH, menaikkan nilainya, jika dituangkan di tengah tempat reaksi ditemukan.
-Jalankan sebagai Reagen kimia untuk sejumlah besar reaksi.
Basis dapat menjadi spesies yang berbeda, keduanya kimia anorganik sejak Kimia organik, Seperti Hidroksida, itu amina dan Alkohol, sebagai contoh.
Untuk menentukan perilaku Basa, tiga Teori Asam-Basa utama digunakan: Teori Arrhenius, Bronsted-Lowry dan Lewis.
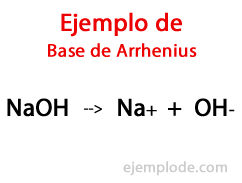
Pangkalan menurut Arrhenius
Menurut Ahli Kimia Swedia Svante Arrhenius, Basa adalah zat kimia yang chemical memberikan ion hidroksil (OH-) ke media reaksi, terutama jika itu adalah larutan berair. Jadi, dengan ion hidroksil yang tersedia, akan ada pH basa, yaitu dengan nilai lebih besar dari 7, dan hingga 14 tergantung pada seberapa banyak Basis hadir pada saat pengukuran.
Ini adalah salah satu teori yang paling sederhana dan paling praktis untuk diterapkan, karena tidak memiliki komplikasi untuk membedakan zat yang mengambil bagian dalam reaksi. Sudah diketahui mana yang Asam dan mana yang Basa.
Dalam Teori ini, ada Hidroksida anorganik yang tak terbantahkan, seperti Natrium Hidroksida (NaOH) dan Kalium Hidroksida (KOH).
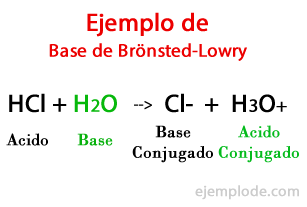
Pangkalan menurut Brönsted-Lowry
Menurut teori yang dirumuskan oleh orang Denmark Johannes Bronsted dan Inggris Thomas Martin Lowry, Basa adalah spesies Kimia mampu menerima Proton yang akan diberikan oleh Asam lainnya, selama reaksi kimia. Proton umumnya berkaitan dengan muatan positif yang mencirikannya, sehingga kita dapat mengasosiasikannya lagi dengan ion Hidrogen (H+).
Ketika pertukaran terjadi dalam reaksi kimia, produknya disebut: "Asam Basa Terkonjugasi", dan "Asam Basa Terkonjugasi", berdasarkan reaktan yang membentuknya.
Untuk Teori ini, Amonia (NH3) adalah kasus yang paling representatif. Untuk Brönsted dan Lowry, zat yang mampu menahan ion Hidrogen (H +) adalah Basa. Dalam hal ini, Amonia, dengan berperilaku sebagai Basa, akan memperoleh Hidrogen dalam strukturnya, mengkonsolidasikan dirinya sebagai ion Amonium (NH4+), dengan kelebihan muatan positif Hidrogen. Amonium adalah Asam Terkonjugasi Amonia.
Amina, senyawa organik yang berasal dari Amonia (NH3), seperti Metil Amina (CH3NH2), ketika dalam larutan mereka berperilaku sebagai Basa, dan mampu menerima muatan positif dalam strukturnya, baik dari Hidrogen atau Karbokation.
Karbokation adalah ion organik yang terbentuk sebagai rantai hidrokarbon, yang tanpa adanya ion negatif, yang Ini bisa berupa Hidroksil (OH-) atau Halogen (Cl-, Br-), ia cenderung mengikat ke situs yang dapat menerimanya, yang akan menjadi Mendasarkan.
Basa menurut Lewis
Ilmuwan Amerika Gilbert lewis menunjukkan dalam Teori Asam-Basanya bahwa Basa adalah zat-zat yang mampu menyumbangkan pasangan elektron bebasnya kepada zat lain untuk melengkapi oktetnya.
Teori Asam-Basa ini merupakan pelengkap untuk menegaskan kembali validitas Rule of the Octet-nya, yang di dalamnya menjelaskan bagaimana atom memperoleh stabilitas dengan mencapai jumlah delapan elektron di kulit terakhirnya, menggunakan Ikatan kovalen
Ion Hidroksil adalah contoh yang baik dari Basa Lewis. Ia memiliki sepasang elektron bebas yang dapat dijangkau oleh ion Hidrogen yang tidak memiliki elektron. Sebuah molekul Air akan terbentuk. Dengan demikian oktet untuk oksigen molekul akan terbentuk, dan hidrogen, yang merupakan atom yang lebih kecil, akan memiliki pasangan elektron yang akan membuatnya stabil.

Penggunaan Basis Penting
Itu Natrium Hidroksida NaOH Ini umumnya digunakan dalam larutan berair untuk membersihkan lemak yang dipadatkan di kompor domestik dan industri, melarutkannya secara efektif. Ini juga digunakan, dalam larutan pekat, ketika tumpahan zat asam yang tidak terduga terjadi, untuk menetralkannya.
Itu Magnesium Hidroksida Mg (OH)2 Ini digunakan dalam larutan yang disebut "Susu Magnesia", untuk mengatasi mulas, menetralkannya. Itu dijual di apotek.
Itu Kalium Hidroksida KOH Ini digunakan sebagai reagen untuk proses Saponifikasi, mengubah lemak menjadi Sabun.
Itu Amonia NH33 Ini digunakan dalam bentuk gasnya sebagai pendingin industri, terutama pada pembuat es. Penggunaannya sangat berbahaya, karena menghirup konsentrasi 5 miligram per liternya di udara bisa berakibat fatal.
Contoh Basa Kimia
Air H2ATAU
Amonia NH33
Natrium Hidroksida NaOH
Kalium Hidroksida KOH
Magnesium Hidroksida Mg (OH)2
Kalsium Hidroksida Ca(OH)2
Aluminium Hidroksida Al (OH)3
Amonium Hidroksida NH34Oh
Besi Hidroksida Fe (OH)2
Besi Hidroksida Fe (OH)3
Ion Hidroksil (OH-)
Ion Klorida (Cl-)
Ion Bromida (Br-)



