Definizione di geometria molecolare
Varie / / January 11, 2022
Definizione concettuale
È la struttura di una molecola che determina la disposizione tridimensionale degli atomi che la compongono nello spazio.

Ingegnere chimico
Le geometrie molecolari sono attualmente definite in base alla Teoria di repulsione delle coppie elettroniche dello strato di Valencia (TRPECV). Questa teoria permette di prevedere il comportamento chimico di sostanze (nello specifico covalenti) e aiuta a comprendere il distribuzione elettronica, che porta a geometria del molecola. Questo, a sua volta, ci permette di comprendere molte delle proprietà che acquisiscono le sostanze.
Questa Teoria si basa su una serie di pilastri fondamentali che esamineremo e poi cercheremo di comprendere applicazione la pratica. In primo luogo, gli elettroni legati e non legati (di valenza) sono pensati come un mare di elettroni che, per possiedono lo stesso tipo di carica, si respingono, quindi saranno sempre posizionati il più lontano dall'atomo centrale del molecola.
In secondo luogo, questo "mare" di elettroni o "nuvola elettronica" forma aree ad alta densità di elettroni, che sono costituiti in legami, dove gli elettroni sono condivisi o in coppie di elettroni non condivisi. A loro volta, i legami che si formano possono essere singoli, doppi o anche tripli.
Infine, per decidere geometria molecolare, è molto utile avere la struttura di Lewis, dove verrà contata la quantità di densità di elettroni attorno all'atomo centrale e questo darà indicazione dal nome della sua geometria e dalla forma che assume tridimensionalmente la molecola.
Va notato che queste densità saranno collocate il più distanti possibile, in modo da adottare la struttura più stabile e dove c'è meno repulsione. È così che si identifica prima la geometria elettronica e poi la geometria molecolare.
Sei livelli di densità
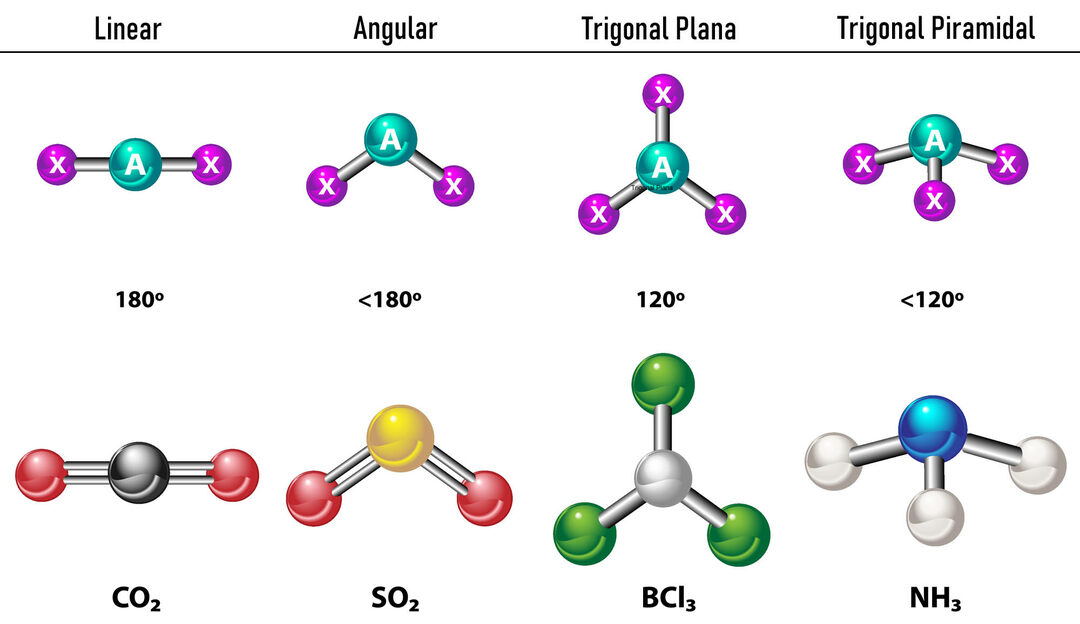
Nel caso in cui ci siano due densità di elettroni attorno all'atomo centrale, i legami saranno posizionati il più lontano possibile tra loro, cioè a 180º l'uno dall'altro e, quindi, la loro geometria elettronica è lineare e anche molecolare è lineare.
Nel caso in cui ci siano tre densità di elettroni attorno all'atomo centrale, ci sono due opzioni: tre legami o due legami e una coppia non legata. Se ci sono tre legami, la geometria elettronica lo è Piatto trigonale, con angoli di 120º tra i legami e la geometria molecolare prende lo stesso nome. Ora, se c'è una coppia non legata, si respingono a vicenda con di più intensità che le cariche legate tendono quindi a comprimere gli angoli di legame. L'angolo tra la coppia libera e ciascun legame è di 120º e la geometria elettronica è Trigonal Plane mentre la geometria molecolare è Angular.
Nel caso in cui ci siano quattro densità di elettroni attorno all'atomo centrale, la geometria elettronica è tetraedrica. Se tutte e quattro le coppie di elettroni sono legate, la loro geometria molecolare coincide di nome con la loro geometria elettronica e l'angolo di legame è 109,5º. Ora, se una delle coppie è libera, l'angolo di legame si riduce (107º) e la geometria molecolare è di tipo Piramide Trigonale. Infine, se due sono coppie libere e due sono legate, l'angolo di legame è 104,5º mentre la geometria molecolare è chiamata Angolare.
Quando le densità di elettroni attorno all'atomo centrale sono cinque, si parla di a Bipiramide trigonale la sua geometria elettronica. Se tutti i carichi sono collegati, ci sono angoli di 120ºC tra i collegamenti equatoriali e di 90º tra quelli assiali con quelli equiatoriali. Ora, la geometria molecolare è anche chiamata Bipiramide Trigonale mentre, avendo quattro coppie collegate e una coppia libera, la geometria molecolare è distorta formando il noto "rocker”, Ecco il nome che acquisisce Tetraedro distorto. Invece, se due delle cinque coppie di elettroni sono libere e tre di esse sono legate, ha una geometria a “T” e il suo nome è proprio dovuto alla sua struttura. Infine, se è il contrario, tre coppie libere e due cariche legate, la geometria molecolare è lineare.
Infine, ci sono sei densità di elettroni attorno all'atomo centrale e si forma un ottaedro, da cui il suo nome in geometria elettronica. Allo stesso modo, la geometria molecolare è denominata se tutte le sue coppie sono collegate. Se hai cinque coppie collegate e una coppia libera, la geometria molecolare è la piramide a base quadrata. Se hai quattro coppie legate e due coppie libere, la geometria molecolare è Piatto quadrato.
Figura: dolce natura
Argomenti di geometria molecolare


