Esempi di reazioni endotermiche
Esempi / / November 09, 2023
UN reazione endotermica È una reazione che assorbe energia dal mezzo sotto forma di calore. In queste reazioni, affinché i reagenti si trasformino in prodotti, è necessario che assorbano calore, il che fa sì che i prodotti abbiano un'energia maggiore rispetto ai reagenti che li hanno originati. Alcuni esempi di reazioni endotermiche sono: fotosintesi ed elettrolisi dell’acqua.
- Guarda anche: Reazioni chimiche
Esempi di reazioni endotermiche nella vita quotidiana
Alcune delle principali reazioni endotermiche sono:
Produzione di ozono nell'atmosfera. L'ozono viene prodotto nell'atmosfera quando l'ossigeno molecolare (O2) assorbe la radiazione ultravioletta e si decompone. Quindi un atomo di ossigeno (O) può interagire con un'altra molecola di ossigeno (O2) e formano ozono (O3).

Elettrolisi dell'acqua. È il processo attraverso il quale viene applicato energia elettrica all'acqua per separarla nei suoi due componenti, idrogeno (H) e ossigeno (O).
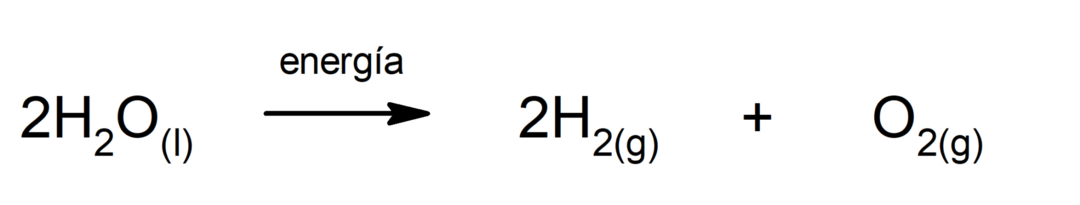
Fotosintesi. È la reazione chimica mediante la quale, assorbendo
energia solare, anidride carbonica (CO2) viene trasformato in glucosio. Questa reazione costituisce la principale via di nutrizione per le piante.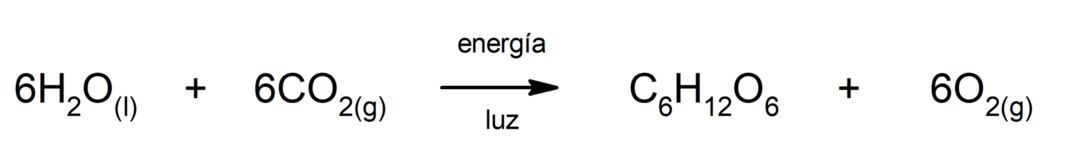
Produzione di solfuro di ferro (II).. Perché avvenga la reazione tra zolfo e ferro è necessario fornire energia sotto forma di calore.
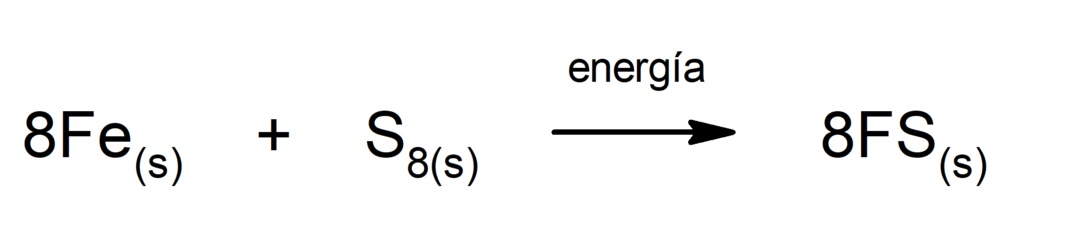
Decomposizione dell'anidride carbonica (CO2). La decomposizione del CO2 Ad alte temperature produce monossido di carbonio (CO) e ossigeno (O2).
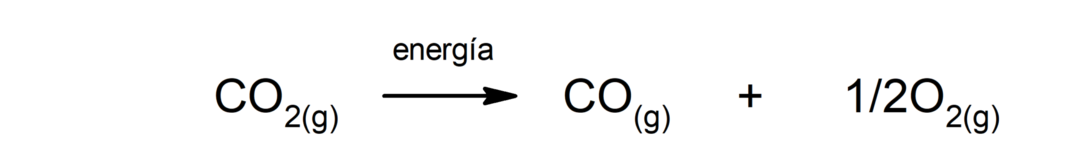
Decomposizione del carbonato di calcio (CaCO3). Il carbonato di calcio si decompone con l'assorbimento di calore per produrre ossido di calcio (CaO) e anidride carbonica (CO2).
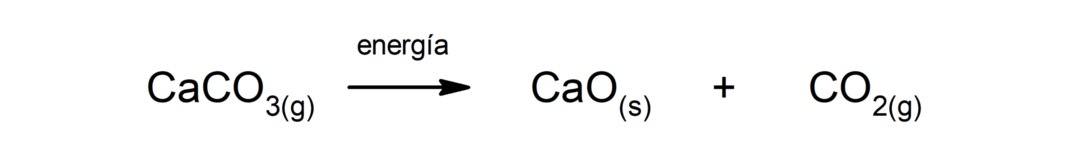
Differenza tra reazione endotermica ed esotermica
La principale differenza tra reazioni endotermiche ed esotermiche è che le reazioni endotermiche assorbono calore, mentre le reazioni esotermiche rilasciano calore.
Inoltre, le reazioni endotermiche sono caratterizzate da un aumento dell'entalpia, mentre le reazioni esotermiche sono associate ad una diminuzione dell'entalpia.
L'entalpia è una quantità termodinamica che definisce il flusso di energia termica a pressione costante durante una reazione chimica. È rappresentato dalla lettera H e la sua variazione è uno dei principali indicatori per definire se una reazione chimica è endotermica o esotermica.
- Se una reazione chimica ha una variazione di entalpia maggiore di zero (∆H > 0) è endotermico.
- Se una reazione chimica ha una variazione di entalpia inferiore a zero (∆H < 0) è esotermico.
Segui con:
- Fenomeni fisico-chimici
- La chimica nella vita quotidiana
- La chimica nella vita quotidiana
- Chimica organica e inorganica
Riferimenti
- Soto-Córdoba, S. (2016). Reazioni endotermiche. Archivio tecnologico Istituto Tecnologico del Costa Rica.
- Coromina, J. (2017). Reazioni chimiche della vita quotidiana. Alambicco, (90), 8-26.
- Sanchez, M. T. M., & Sanchez, M. M. (2002). Studio sperimentale delle reazioni endotermiche per gli studenti dell'ESO. Annali di Chimica della RSEQ, (4), 36-39.