Esempio di elementi chimici
Chimica / / July 04, 2021
Un elemento chimico è una sostanza pura composta da atomi dello stesso tipo, a sua volta formato da un numero di protoni e neutroni nel nucleo, e una quantità di elettroni nei loro orbitali. Alcuni si trovano naturalmente, altri formando le molecole di un composto, altri ancora sono stati creati attraverso l'esecuzione di procedure di laboratorio. Tutti gli elementi chimici costituiscono la materia dell'intero universo e sostengono l'esistenza e il funzionamento del corpo umano.
Ogni elemento ha caratteristiche e comportamenti che lo contraddistinguono e lo rendono unico, ma allo stesso tempo presenta somiglianze con un gruppo di elementi nella manifestazione che hanno nella universo. Per questo motivo esiste la Tavola Periodica degli Elementi Chimici, che affronta queste somiglianze per raggruppare coerentemente gli elementi, e facilitare lo studio delle loro proprietà.
Numero atomico di un elemento
l'atomo trasporta nel nucleo un numero di protoni, accompagnato da altrettanti neutroni. A questo numero
si chiama numero atomico, rappresentato come Z per scopi accademici e in Letteratura. Per ogni Elemento, questo numero sarà unico. Non esistono due Elementi con lo stesso numero atomico. Anche la tavola periodica si sofferma su questo criterio per ordinarli.Simbolo di un elemento
Nei tempi dell'Alchimia, che vanno dal 400 al 1000 d.C. circa. C., gli Alchimisti registrarono i loro esperimenti assegnando simboli agli elementi. Erano semplici simboli, realizzati con figure geometriche, per rappresentare il singolo elemento e le trasformazioni studiate.
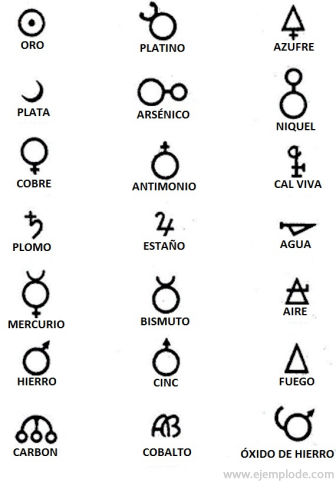
Alcuni esempi di simboli alchemici, con il nome dell'elemento o composto che rappresentavano.
Nell'Era della Chimica Moderna, gli Elementi sono ancora rappresentati con simboli, in questo caso lettere che rimandano al loro nome in latino o in inglese.
Per esempio:
Il simbolo del sodio è N / A, con il suo nome latino Natrium
Il simbolo dell'oro è Au, con il suo nome latino Aurum
Il simbolo dell'argento è Ag, con il suo nome latino Argentum
Il simbolo del rame è Cu, con il suo nome latino Cuprum
Il simbolo dell'antimonio è Sb, con il suo nome latino Stibium
Il simbolo del ferro è Fede, con il suo nome latino Ferrum
Il simbolo di Mercurio è Hg, con il suo nome latino Hydrargyrum, che significa "argento liquido"
Il simbolo del potassio è K, con il suo nome latino Kalium
Gruppi di elementi chimici:
La tavola periodica degli elementi chimici li classifica per gruppi: gruppi A e gruppi B. I Gruppi A sono otto, che contengono gli Elementi Alcalino, il Alcalino-terroso, il Terreos, tre famiglie di Elementi, la cui testa definisce il nome della famiglia: Famiglia del carbonio, Famiglia dell'azoto, Famiglia di zolfo, il Alogeni e il gas nobili. I gironi B sono composti da tutti i Metalli di transizione e le Terre Rare, che sono anche due grandi Famiglie: lantanidi sì attinidi.
Gruppo IA: elementi alcalini:
La serie degli elementi alcalini è costituita da Idrogeno (H), Litio (Li), Sodio (Na), Potassio (K), Rubidio (Rb), Cesio (Cs) e Francio (Fr). Hanno tutti una configurazione elettronica tale che nell'ultimo guscio hanno un elettrone. Il loro nome è dovuto al fatto che quando entrano in contatto con l'acqua reagiscono formando Alcali o Idrossidi. È un comportamento generale tra questi elementi. Più grande è l'atomo dell'elemento, più è reattivo, poiché la forza con cui il nucleo trattiene l'elettrone dall'ultimo guscio ha sempre meno portata. Sono in grado di formare legami ionici con alogeni. Ad esempio: Il legame ionico che ha una presenza abbondante è quello di Sodio-Cloro, formando Sodio Cloruro NaCl.
Gruppo IIA: elementi alcalino-terrosi:
Questi elementi sono: Berillio (Be), Magnesio (Mg), Calcio (Ca), Stronzio (Sr), Bario (Ba) e Radio (Ra). Non sono liberi in natura; d'altra parte, i suoi carbonati e silicati esistono in relativa abbondanza. Sono argentini bianchi e cristallini. Si combinano facilmente con l'ossigeno se esposti all'aria. Ciò è dovuto, in parte, al fatto che hanno due elettroni nel loro ultimo guscio, coerente con la capacità di ricevere ossigeno. Il Bario è l'elemento più attivo del gruppo e, insieme al Calcio, sono quelli con le applicazioni più industriali del gruppo.
Gruppo IIIA: Elementi della Terra:
Il gruppo IIIA comprende gli elementi Boro (B), Alluminio (Al), Gallio (Ga), Indio (In) e Tallio (Tl). Il Boro è un elemento non metallico, l'Alluminio è anfotero (anfiprotico), cioè è in grado di agire sia da acido che da base; e gli altri tre sono elementi metallici. Hanno tre elettroni nel loro ultimo guscio, generando una valenza di +3, sebbene a volte il gallio agisca con una valenza +1 e +2 in alcuni dei suoi composti. Il boro è l'unico elemento di questa serie che forma gli idruri. Boro e alluminio formano carburi.
Gruppo IVA: Carbon Famiglia:
Gli elementi rappresentativi del gruppo IVA sono Carbon (C), Silicio (Si), Germanio (Ge), Stagno (Sn) e Piombo (Pb). I primi due sono fondamentalmente non metallici nelle loro caratteristiche, ma Germanio, Stagno e Piombo sono metallici, e tanto più quanto più alto è il loro numero atomico. Ad eccezione del Silicio, ogni elemento ha le valenze +4 e +2.
Il carbonio e il silicio formano composti in cui gli atomi degli elementi sono uniti da coppie di elettroni condivisi. Il carbonio è l'essenza dei composti organici associandosi con atomi di idrogeno, ossigeno, azoto, zolfo e talvolta silicio.
Il silicio e il germanio vengono utilizzati per la fabbricazione di componenti elettronici, in quanto hanno la proprietà di comportarsi come semiconduttori.
Gruppo VA: Famiglia dell'azoto:
Il gruppo VA comprende gli elementi Azoto (N), Fosforo (P), Arsenico (As), Antimonio (Sb) e Bismuto (Bi). L'azoto e il fosforo sono non metallici, l'arsenico e l'antimonio sono metalloidi e il bismuto è un metallo. Questi elementi sono caratterizzati dalla formazione di idruri, di cui la meno tossica è l'ammoniaca NH3. L'azoto forma acido nitrico HNO3, coinvolto insieme all'Acido Cloridrico nell'Agua Regia, una miscela in grado di dissolvere metalli preziosi come Oro e Argento.
L'azoto è coinvolto anche in due grandi gruppi di composti organici chiamati Amine e Amidi, che possono essere considerati derivati dell'Ammoniaca NH3, per sostituzione di un idrogeno con una catena di idrocarburi.
Gruppo VIA: Famiglia dell'ossigeno:
Costituito dagli elementi Ossigeno (O), Zolfo (S), Selenio (Se), Tellurio (Te) e Polonio (Po). L'ossigeno è il più attivo e ha la capacità di formare facilmente legami covalenti. A contatto con metalli in un ambiente ad alta umidità, forma ossidi. Forma una molecola risonante chiamata Ozono, che protegge il pianeta dalle radiazioni UV.
Gruppo VIIA: Alogeni:
Il suo nome significa "Formatori di vendita". Il gruppo è formato dagli elementi Fluor (F), Cloro (Cl), Bromo (Br), Iodio (I) e Astato (At). Hanno sette elettroni nell'ultimo guscio, il che consente loro di essere recettori per un elettrone. Questa qualità li fa legare agli elementi del gruppo IA, formando sali binari. Il fluoro è caratterizzato dall'avere la più grande elettronegatività dell'intera tavola periodica, con un valore di 4.0, la sua controparte è il cesio, con elettronegatività di 0,7. Questa proprietà gli permette di avere la forza di attrarre altri atomi e di dare priorità alla formazione di un legame con essi.
Gruppo VIIIA: Gas Nobili:
Chiamato anche Inert Gas Group, è formato dagli elementi Elio (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) e Radon (Ra). Sono gli elementi che hanno tutta la loro configurazione elettronica completa, quindi non sono in grado di reagire in condizioni normali. Sono utilizzati principalmente per insegne commerciali luminose, emettendo luce visibile quando una corrente elettrica è incidente su di esse.
Gruppi B: Metalli di transizione:
In dieci gruppi di tre elementi ciascuno, i metalli di transizione sono raggruppati. Questi includono i migliori conduttori elettrici: Argento (Ag), Rame (Cu), Oro (Au); i migliori componenti strutturali per l'edilizia e l'ingegneria urbana; Ferro (Fe), Titanio (Ti), Alluminio (Al), Zirconio (Zr), Tungsteno (W); i migliori componenti del catalizzatore: Nichel (Ni), Vanadio (V), Platino (Pt); e i principali ingredienti del rivestimento: Cadmio (Cd), Cromo (Cr), Zinco (Zn). Di solito gestiscono le valenze tra +1 e +3, ma elementi come Chromium gestiscono le valenze +2, +3, +6.
Terre rare: lantanidi e attinidi:
Sono chiamate Terre Rare a causa della loro scarsità sul pianeta. Sono costituiti da due gruppi: lantanidi e attinidi. Si trovano sulle due righe separate della tavola periodica. Funzionano con una valenza di +3 generalmente e tendono a formare idrossidi. L'elemento più importante tra questi è il cerio, che viene utilizzato nella preparazione di leghe piroforiche (Alloy Mischmetal, per pietre per accendini), nei tubi del gas per l'illuminazione e nella fabbricazione di vetri speciali che assorbono i raggi ultravioletti e le radiazioni termiche.
Fanno parte di questi gruppi gli elementi radioattivi più potenti, come l'uranio (U) e il plutonio (Pu). che data la loro instabilità, rilasciano energia e si disintegrano, perdendo le particelle Alfa (nuclei di Elio). In seguito diventano elementi meno instabili, secondo la serie radioattiva.



