Esempio di nomenclatura dei composti organici
Chimica / / July 04, 2021
I composti organici sono molecole la cui caratteristica è quella di essere formati da una base di molecole di carbonio e idrogeno, noto anche come scheletro, e combinato con altri elementi, principalmente ossigeno, azoto e zolfo.
Il IUPAC (Unione internazionale di chimica pura e applicata, Unione internazionale di chimica pura e applicata) ha stabilito regole generali per la classificazione e la nomenclatura delle molecole organiche, di cui spieghiamo le più importanti.
Idrocarburi
Gli idrocarburi sono le molecole organiche più semplici, costituite da uno scheletro di carbonio e atomi di idrogeno. Esistono tre tipi di idrocarburi:
alcani
Sono i più semplici, formati da atomi di carbonio uniti da semplici legami covalenti agli atomi di idrogeno, con la formulazione generale H = 2n + 2, cioè gli atomi di idrogeno sono il doppio del numero degli atomi di idrogeno. carbonio, più 2. La sua nomenclatura è formata con i prefissi numerici met- per 1 atomo di carbonio, et- per 2, prop- per 3 e but- per 4; da 5 atomi di carbonio vengono usati i comuni prefissi pent-, hex-, hept-, oct-, ecc. A tutti gli alcani viene aggiunta la desinenza -ano.
Esempio: CH4: metano; C2H6: etano; C4H10: butano; C6H14: esano
alcheni
Sono formati da uno scheletro di carbonio in cui esiste un doppio legame tra gli atomi di carbonio. La sua formula generale è H = 2n, cioè i suoi atomi di idrogeno sono il doppio del numero di atomi di carbonio. Come gli alcani, usano prefissi che indicano il loro numero di atomi di carbonio, e in questo caso viene aggiunta la desinenza -eno. Inoltre, nelle molecole con più di tre atomi di carbonio, il carbonio dove si trova il doppio legame, iniziando a contare dal carbonio più vicino a è.
Esempi: C2H4: etene; C3H6: propene; C4H8: butene, 2-butene; C6H12: Esene, 2-esene (doppio legame sull'atomo 2), 3-esene (doppio legame sull'atomo 3).
alchini
Gli alchini contengono un triplo legame ai loro atomi di carbonio. La sua formula generale è H = 2n-2, indicando che la molecola conterrà due atomi di idrogeno in meno del doppio del numero di atomi di carbonio. Al prefisso che indica il numero di carboni si aggiunge la desinenza -ino. Come nel caso degli alcheni, viene menzionato il carbonio contenente il triplo legame, contato dall'estremo più vicino ad esso.
Esempi: C2H2: etino; C3H4: mancia; C4H6: butino, 2-butino; C6H12: Hexino, 2-esene (triplo legame all'atomo 2), 3-esano (triplo legame all'atomo 3).
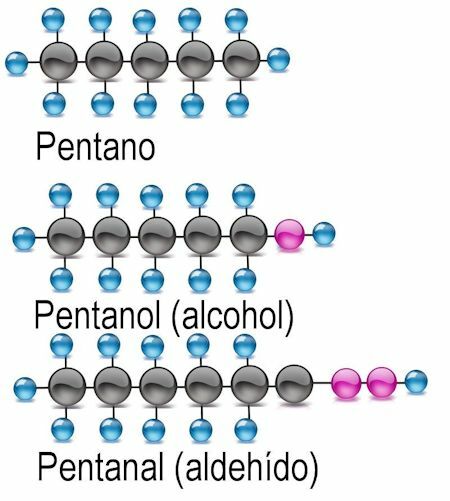
Gruppi funzionali
I gruppi funzionali sono combinazioni di atomi che funzionano come ioni e sostituiscono un atomo di idrogeno nella formula di un alcano.
radicali
L'alcano senza l'atomo di idrogeno è detto Radicale, e per identificarlo si aggiunge la desinenza -ilo:
Esempi CH4: metano - CH3+ metile; C2H6: etano - C2H5+ etilico; C4H10: butano - C4H9+ butile; C6H14: esano - C6H13+ esile.
Combinazione di idrocarburi
Uno dei casi che possono verificarsi è che due o più idrocarburi si combinano in una molecola. Gli idrocarburi con cui si combina sono chiamati arborescenze. In questi casi, l'idrocarburo di base sarà quello con la catena più lunga e il numero di carbonio dove si trovano le arborescenze, seguite dal nome del radicale con la desinenza -il, e poi dal nome dell'idrocarburo base. Il numero sarà menzionato tante volte quanti sono gli alberi ad esso collegati. Nel caso in cui le arborescenze siano dello stesso radicale in atomi di carbonio diversi, verranno citati i numeri separati da virgole, seguiti da un trattino, il nome del radicale, quindi i numeri degli atomi a cui è attaccato l'altro radicale, se presente, un trattino, il nome del radicale e il nome dell'idrocarburo base. Nel caso ci siano due radicali attaccati allo stesso atomo di carbonio, il numero sarà menzionato due volte. Se sono radicali diversi, verrà menzionato una volta prima del nome di ciascun radicale; se i radicali sono uguali, il numero sarà menzionato due volte. Inizieremo citando prima le arborescenze più semplici (quelle con la minor quantità di carbonio) e poi quelle con la quantità maggiore.
Esempio: una molecola di pentano, con due radicali etano, attaccati al carbonio 2 e 3:
2,3-etil pentano. Una molecola di ottano, un radicale propano al carbonio 6, radicali metano ai atomi di carbonio 4 e 5 e radicali etano, legati ai atomi di carbonio 2, 3 e 4: 4,5-metil-2,3,4-etil-6-propile -ottano.
Gruppo funzionale alcol
Il più semplice dei gruppi funzionali è l'alcol, in cui un atomo di idrogeno è sostituito da un gruppo ossidrile (OH). In questi composti la desinenza -anol è aggiunta al nome del radicale. Se del caso, dovrebbe essere menzionato l'atomo di carbonio in cui si trova il gruppo funzionale:
Esempi CH3OH: metanolo: C2H5OH etanolo; C4H9OH butanolo o 2-butanolo; C6H13OH esanolo, 2-esanolo (gruppo funzionale all'atomo 2), 3-esanolo (gruppo funzionale all'atomo 3).
Gruppo funzionale aldeidico
Nelle aldeidi, l'atomo di idrogeno viene scambiato con il gruppo funzionale -CHO. Per identificarli si aggiunge la desinenza -anal, e si menziona anche l'atomo di carbonio dove si trova il gruppo funzionale:
Esempi CH3COH: metano: C2H5COH etanico; C4H9COH butanale o 2-butanale; C6H13COH esanale, 2-esanale (gruppo funzionale sull'atomo 2), 3-esanale (gruppo funzionale sull'atomo 3).
Gruppo funzionale acido
Negli acidi organici, l'atomo di idrogeno viene scambiato con il gruppo funzionale -COO. Per identificarli si menziona la parola acido e si aggiunge la desinenza -anoico, e si menziona anche l'atomo di carbonio dove si trova il gruppo funzionale:
Esempi CH3COOH: acido metanoico: C2H5acido etanoico COOH; C4H9COOH acido butanoico o acido 2-butanoico; C6H13COH acido esanoico, acido 2-esanoico (gruppo funzionale all'atomo 2), acido 3-esanoico (gruppo funzionale all'atomo 3).
