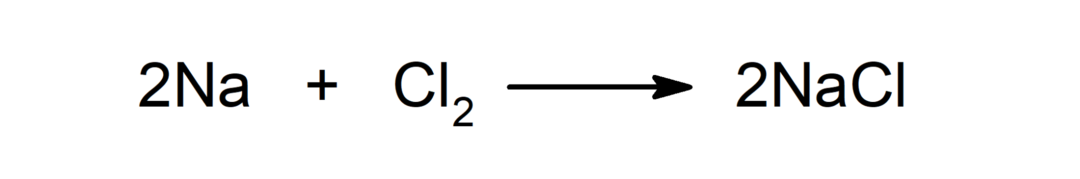分子間力の定義(双極子-双極子、イオン-双極子、ロンドン、およびP。 水素)
その他 / / December 02, 2021
概念的な定義
名前が示すように、それらは化合物の分子間で相互作用する力です。 分子を構成する原子間に発生する分子内力もあることを明確にする価値があります。

化学技術者
基本的に、最も典型的な3つの分子間力があり、このセクションで取り上げます。 さて、なぜこれらのタイプの力の研究は興味深いのですか? まあ、それは沸点や融点などのいくつかの化学的性質を予測することができるからです。
次の化合物MgO、NOがあるとします。2、HFおよびF2 沸点を上げて並べ替える必要があります。 私たちはそれを知っています 強さ から アトラクション それらの間で、私たちはより多くを提供する必要があります エネルギー リンクを解除します。 したがって、相互作用する力とは何かを理解する必要があります。
MgOの場合、それはイオン性化合物であるため、それをまとめる力は静電的であり、すべての中で最も強いため、沸点が最も高くなります。 次に、NOとHFおよびFを比較すると
この分析に基づいて、最高の沸点はMgO、次にHF、次にNOであることが知られています。 2 そして最後にF2.
ロンドン軍
分散力とも呼ばれ、すべての分子化合物に存在します。 ただし、極性分子では、双極子が存在するために重要性が失われ、他のより関連性の高い力が存在します。 したがって、無極性分子では、それらが存在する唯一の力です。
モル質量が大きいほど、ロンドン力は大きくなります。 次に、非極性分子は一時的または一時的な双極子を形成します。つまり、電子雲は連続体によって変形します。 動き その電子の。 その電子雲が大きく、分極性が高いほど、相互作用するロンドン力は大きくなります。
典型的な例は、Clなどの二原子化合物です。2 構造に対称性があり、それを形成する2つの原子が同じ電気陰性度を持っているという事実に加えて、結合は無極性であり、分子も無極性です。 COの場合
2、主な力は散乱力でもあります。 ただし、分子の対称構造が与えられると、双極子をキャンセルして無極性分子を形成する極性結合を観察します。双極子-双極子力
分子が対称性を示さず、永久双極子が生成される場合、分子は極性であるか、双極子モーメントがゼロではないと言われます。 これは、分子の帯電した端の間に引力を生成する双極子-双極子力の存在を意味します。 ある分子の正の電子密度を持つ端と別の分子の負の電子密度を持つ端 分子。 もちろん、電子密度を扱う場合、これらの力は、前述したように、すべての分子に存在するロンドンの力よりも強力です。
典型的な例はH分子です2SおよびHBrは、その形状により、負の電荷密度を持つ領域が別の分子の正に帯電した密度と強く相互作用します。
水素架橋力
このタイプの力は、水素とフッ素、窒素、または酸素との間の結合である双極子-双極子力の特定のケースを指します。 それらは、強く結合する前述の原子間の双極子の力の積であり、したがって、 それらは他のどの力よりも強いので、特定の名前で指定します 双極子-双極子。 これは水分子(H2O)またはアンモニア(NH3).
イオン-双極子力
これは、私たちが目にする最後のタイプの分子間力であり、イオンが化合物に関与している場合に発生します。 この インタラクション 次に、イオンと極性分子の双極子の間で発生します。 解散 から 外出します 水中で、MgClとして2 水中で。 水とイオン種が溶解したMgとの相互作用の極性分子の永久双極子+2 とCl-.
見られるこれらのタイプの力は、共有結合およびイオン結合よりも弱く、それぞれ共有結合およびイオン性化合物に存在することに注意する必要があります。
分子間力のトピック(双極子-双極子、イオン-双極子、ロンドン、およびP。 水素)