吸熱反応の例
例 / / November 09, 2023
あ 吸熱反応 これは媒体から熱の形でエネルギーを吸収する反応です。 これらの反応では、反応物が生成物に変化するためには、反応物が熱を吸収する必要があり、その結果、生成物は、その生成物を生じた反応物よりも大きなエネルギーを持つことになります。 吸熱反応の例は次のとおりです。 光合成と水の電気分解。
- 以下も参照してください。 化学反応
日常生活における吸熱反応の例
主な吸熱反応の一部は次のとおりです。
大気中のオゾン生成. オゾンは分子状酸素(O2)紫外線を吸収して分解します。 その後、酸素原子 (O) は別の酸素分子 (O) と相互作用することができます。2) そしてオゾンを形成します (O3).

水の電気分解. それが適用されるプロセスです 電力 水を水に加えて、水素 (H) と酸素 (O) の 2 つの成分に分離します。
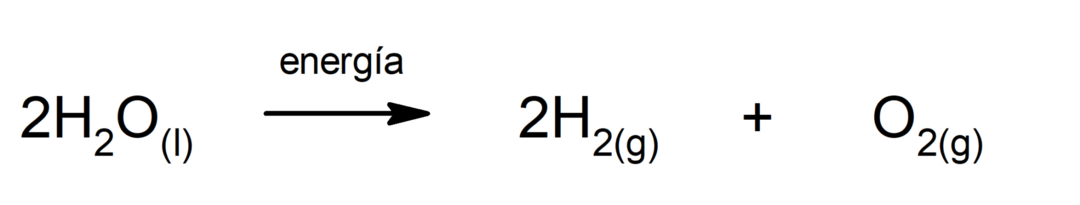
光合成. 吸収する化学反応です。 太陽光エネルギー、二酸化炭素 (CO2)グルコースに変換されます。 この反応は植物の栄養の主な経路を構成します。
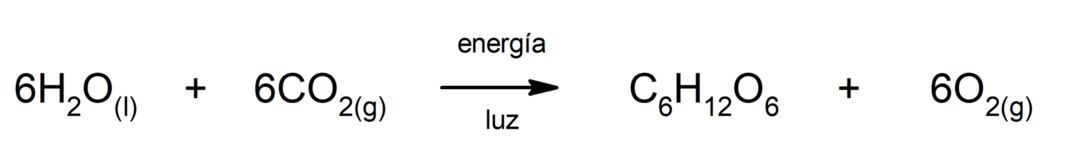
硫化鉄(II)の製造. 硫黄と鉄の反応が起こるには、熱の形でエネルギーを供給する必要があります。
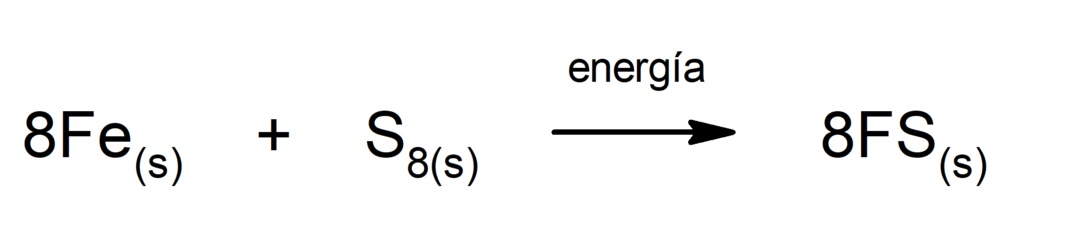
二酸化炭素(CO)の分解2). COの分解2 高温では一酸化炭素(CO)と酸素(O)が発生します。2).
炭酸カルシウム(CaCO)の分解3). 炭酸カルシウムは熱を吸収すると分解し、酸化カルシウム(CaO)と二酸化炭素(CO)が生成されます。2).
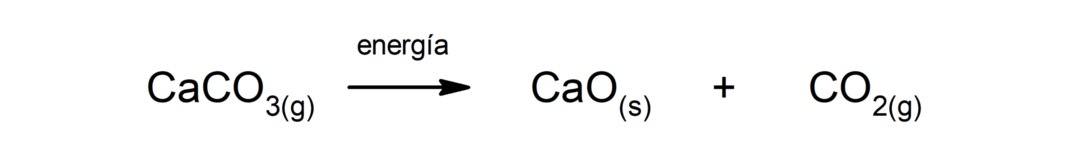
吸熱反応と発熱反応の違い
吸熱反応と発熱反応の主な違いは、吸熱反応は熱を吸収するのに対し、発熱反応は熱を放出することです。
さらに、吸熱反応はエンタルピーの増加を特徴とし、発熱反応はエンタルピーの減少を伴います。
エンタルピーは、化学反応中の一定圧力における熱エネルギーの流れを定義する熱力学量です。 これは文字 H で表され、その変化は化学反応が吸熱か発熱かを定義する主要な指標の 1 つです。
- 化学反応のエンタルピー変化がゼロより大きい場合 (ΔH > 0) は吸熱性です。
- 化学反応のエンタルピー変化がゼロ未満の場合 (ΔH < 0) 発熱します。
以下のように続けてください:
- 物理化学現象
- 日常生活の中の化学
- 日常生活の中の化学
- 有機化学と無機化学
参考文献
- ソトコルドバ、S. (2016). 吸熱反応。 技術リポジトリ コスタリカ工科大学。
- コロミナス、J. (2017). 日常生活で起こる化学反応。 アレンビック、(90)、8-26。
- サンチェス、M. T. M.、サンチェス、M. M. (2002). ESO学生のための吸熱反応の実験研究. RSEQ の化学年報, (4), 36-39.



