化学元素の例
化学 / / July 04, 2021
化学元素 同じ種類の原子からなる純粋な物質です、順番に形成された 原子核内の陽子と中性子の数によって、および 軌道上の電子. 自然に発見されるものもあれば、化合物の分子を形成することによって発見されるものもあり、実験手順の実行によって作成されたものもあります。 すべての化学元素は宇宙全体の問題を構成し、人体の存在と機能を維持します。
各要素には、それを区別し、それをユニークにする特性と動作があります。 しかし同時に、それはそれらが持っている顕現の要素のグループとの類似性を提示します 宇宙。 このため、化学元素の周期表があります。これは、これらの類似性に対処して元素を首尾一貫してグループ化し、それらの特性の研究を容易にします。
元素の原子番号
原子 同じ数の中性子を伴って、核内に多くの陽子を運ぶ. この番号に それは原子番号と呼ばれます、として表される Z 学術目的および文学。 要素ごとに、この番号は一意になります。 同じ原子番号を持つ2つの要素はありません。 周期表はまたそれらを注文するためのこの基準に焦点を当てています。
要素のシンボル
錬金術の時代には、およそ西暦400年から1000年にまたがります。 C.、錬金術師は要素に記号を割り当てて実験を記録しました。 それらは、個々の要素と研究された変換を表すために、幾何学的図形で作られた単純な記号でした。
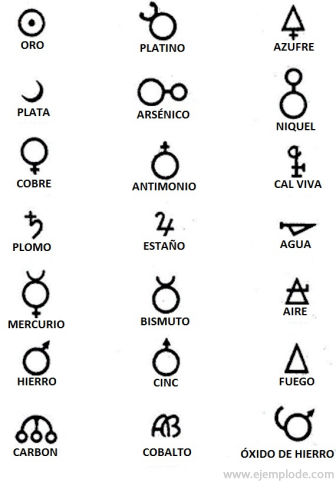
錬金術記号のいくつかの例と、それらが表す元素または化合物の名前。
現代化学の時代では、元素はまだ記号で表されています。この場合、ラテン語または英語でそれらの名前を参照する文字です。
例えば:
ナトリウムのシンボルは ナ、ラテン語の名前で ナトリウム
ゴールドのシンボルは Au、ラテン語の名前で オーラム
シルバーのシンボルは Ag、ラテン語の名前で Argentum
銅のシンボルは Cu、ラテン語の名前で 銅
アンチモンのシンボルは Sb、ラテン語の名前で アンチモン
鉄のシンボルは 信仰、ラテン語の名前で 鉄
水星のシンボルは Hg、ラテン語の名前で Hydrargyrum、「リキッドシルバー」を意味します
カリウムのシンボルは K、ラテン語の名前で カリウム
化学元素グループ:
化学元素の周期表は、これらをグループAとグループBに分類しています。 グループAは8つで、要素が含まれています アルカリ性、 アルカリ性-Earthy、 テレオス、Elementsの3つのファミリ。その頭は、ファミリの名前を定義します。
炭素族, 窒素ファミリー, 硫黄ファミリー、 ハロゲン そしてその 希ガス. グループBはすべての 遷移金属 と希土類、これも2つの偉大な家族です: ランタニド Y アクチニド.グループIA:アルカリ元素:
一連のアルカリ元素は、水素(H)、リチウム(Li)、ナトリウム(Na)、カリウム(K)、ルビジウム(Rb)、セシウム(Cs)、フランシウム(Fr)で構成されています。 それらはすべて、最後のシェルに電子があるような電子配置を持っています。 それらの名前は、水と接触すると反応してアルカリまたは水酸化物を形成するという事実に由来しています。 これは、これらの要素間の一般的な動作です。 原子核が最後の殻からの電子を保持する力がますます少なくなるので、元素の原子が大きいほど、それはより反応性が高くなります。 それらはハロゲンとイオン結合を形成することができます。 例:存在感のあるイオン結合は、塩化ナトリウムを形成する塩素ナトリウムのイオン結合です。 NaCl.
グループIIA:アルカリ土類元素:
これらの元素は、ベリリウム(Be)、マグネシウム(Mg)、カルシウム(Ca)、ストロンチウム(Sr)、バリウム(Ba)、ラジウム(Ra)です。 それらは本質的に自由ではありません。 一方、その炭酸塩とケイ酸塩は比較的豊富に存在します。 それらはアルゼンチンの白で結晶性です。 それらは空気にさらされると酸素と容易に結合します。 これは、部分的には、最後のシェルに2つの電子があり、酸素受容能力と一致しているという事実によるものです。 バリウムはグループの最も活発な元素であり、カルシウムと一緒に、それらはグループの中で最も産業的な用途を持つものです。
グループIIIA:地球の要素:
グループIIIAは、ホウ素(B)、アルミニウム(Al)、ガリウム(Ga)、インジウム(In)、およびタリウム(Tl)の元素で構成されています。 ホウ素は非金属元素であり、アルミニウムは両性(両性)です。つまり、酸および塩基として機能することができます。 他の3つは金属元素です。 それらは最後の殻に3つの電子を持ち、+ 3の原子価を生成しますが、ガリウムはその化合物のいくつかで+1と+2の原子価で作用することがあります。 ホウ素は、このシリーズで水素化物を形成する唯一の元素です。 ホウ素とアルミニウムは炭化物を形成します。
グループIVA:カーボンファミリー:
グループIVAの代表的な元素は、炭素(C)、シリコン(Si)、ゲルマニウム(Ge)、スズ(Sn)、鉛(Pb)です。 最初の2つは基本的に非金属であり、ゲルマニウム、スズ、鉛は金属であるため、原子番号が大きくなります。 シリコンを除いて、各元素の原子価は+4と+2です。
炭素とシリコンは、元素の原子が共有電子のペアによって結合された化合物を形成します。 炭素は、水素、酸素、窒素、硫黄、そして時にはシリコンの原子と結合することによる有機化合物の本質です。
シリコンとゲルマニウムは、半導体のように振る舞う性質を持っているため、電子部品の製造に使用されます。
グループVA:窒素ファミリー:
グループVAは、窒素(N)、リン(P)、ヒ素(As)、アンチモン(Sb)、ビスマス(Bi)の元素で構成されています。 窒素とリンは非金属であり、ヒ素とアンチモンは半金属であり、ビスマスは金属です。 これらの元素は、水素化物を形成することを特徴とし、その中で最も毒性が低いのはアンモニアNHです。3. 窒素は硝酸HNOを形成します3、金や銀などの貴金属を溶解できる混合物である王水に塩酸と一緒に関与します。
窒素は、アミンとアミドと呼ばれる有機化合物の2つの大きなグループにも関与しており、これらはアンモニアNHの誘導体と見なすことができます。3、炭化水素鎖による水素の置換による。
グループVIA:酸素ファミリー:
元素酸素(O)、硫黄(S)、セレン(Se)、テルル(Te)、ポロニウム(Po)で構成されています。 酸素は最も活性が高く、共有結合を簡単に形成する能力があります。 高湿度環境で金属と接触すると、酸化物を形成します。 それはオゾンと呼ばれる共鳴分子を形成し、それは惑星を紫外線から保護します。
グループVIIA:ハロゲン:
その名前は「セールスフォーマー」を意味します。 このグループは、フッ素(F)、塩素(Cl)、臭素(Br)、ヨウ素(I)、およびアスタチン(At)の元素で構成されています。 それらは最後の殻に7つの電子を持っているので、1つの電子の受容体になることができます。 この品質により、それらはグループIAの元素とリンクし、二成分塩を形成します。 フルーアは、周期表全体の中で最大の電気陰性度を持ち、値が4.0で、対応するものがセシウムであるという特徴があります。 電気陰性度は0.7です。 この特性により、他の原子を引き付ける強さを持ち、結合を形成することを優先することができます。 彼ら。
グループVIIIA:希ガス:
不活性ガスグループとも呼ばれ、ヘリウム(He)、ネオン(Ne)、アルゴン(Ar)、クリプトン(Kr)、キセノン(Xe)、ラドン(Ra)の元素で構成されています。 それらはすべて完全な電子配置を持つ要素であるため、通常の条件下では反応できません。 それらは主に明るい商業標識に使用され、電流がそれらに入射すると可視光を放出します。
グループB:遷移金属:
それぞれ3つの元素からなる10のグループに、遷移金属がグループ化されます。 これらには、最高の導電体が含まれます:銀(Ag)、銅(Cu)、金(Au)。 都市の建設とエンジニアリングに最適な構造コンポーネント。 鉄(Fe)、チタン(Ti)、アルミニウム(Al)、ジルコニウム(Zr)、タングステン(W); 最高の触媒成分:ニッケル(Ni)、バナジウム(V)、プラチナ(Pt); 主なコーティング成分:カドミウム(Cd)、クロム(Cr)、亜鉛(Zn)。 それらは通常+1から+3の間の原子価を処理しますが、クロムのような元素は+ 2、+ 3、+ 6の原子価を処理します。
希土類:ランタニドとアクチニド:
それらは地球上での希少性のために希土類と呼ばれています。 それらは、ランタニドとアクチニドの2つのグループで構成されています。 それらは周期表の2つの別々の行にあります。 それらは一般に+3の原子価で機能し、水酸化物を形成する傾向があります。 その中で最も重要な元素は、自然発火性合金(合金)の調製に使用されるセリウムです。 ミッシュメタル、ライター用石材用)、照明用ガスホース、紫外線や熱放射を吸収する特殊ガラスの製造に使用されます。
ウラン(U)やプルトニウム(Pu)などの最も強力な放射性元素は、これらのグループの一部です。 それらの不安定性を考えると、エネルギーを放出して崩壊し、アルファ粒子(の核 ヘリウム)。 放射性系列によると、後でそれらは不安定性の低い元素になります。



