პერიოდული კანონის განმარტება
Miscellanea / / July 04, 2021
ფლორენცია უჩას მიერ, ივლისში. 2012
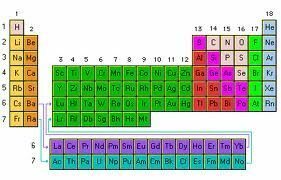 კანონი პერიოდული არის ის საფუძველი პერიოდული ცხრილი ელემენტებისროგორც სქემა უნივერსალური, რომელიც ორგანიზებას უწევს, ახდენს კლასიფიკაციას და ანაწილებს სხვადასხვა არსებულ ქიმიურ ელემენტებს მათი მახასიათებლებისა და თვისებების გათვალისწინებით.
კანონი პერიოდული არის ის საფუძველი პერიოდული ცხრილი ელემენტებისროგორც სქემა უნივერსალური, რომელიც ორგანიზებას უწევს, ახდენს კლასიფიკაციას და ანაწილებს სხვადასხვა არსებულ ქიმიურ ელემენტებს მათი მახასიათებლებისა და თვისებების გათვალისწინებით.
ბაზა, რომელზეც ელემენტების პერიოდული ცხრილი ზის
იმავდროულად, პერიოდული კანონი ითვალისწინებს აღნიშნული ელემენტების ფიზიკურ და ქიმიურ თვისებებს მიდრეკილნი არიან სისტემური გამეორებისკენ, რადგან ელემენტების ატომური რაოდენობა იზრდება.
პერიოდული ცხრილი: ქიმიური ელემენტების ორგანიზება ატომების რაოდენობის მიხედვით, რითაც იზრდება თითოეული
ელემენტების იმდენად ცნობილი ცხრილი, რომელსაც ჩვენ ვსწავლობთ სკოლაფიზიკისა და ქიმიის საგნებში ეს არის სქემა, რომელიც ეხება ქიმიური ელემენტების აწყობას ატომების რაოდენობის მიხედვით მათი მზარდი რიგის მიხედვით.
ცხრილის ვერტიკალურ სვეტებს ჯგუფებს უწოდებენ და შეიცავს იგივე ატომური ვალენტობის მქონე ელემენტებს და, შესაბამისად, აქვთ მსგავსი თვისებები, ხოლო ჰორიზონტალურ მწკრივებში, პერიოდებად წოდებული, დაჯგუფებულია სხვადასხვა თვისების, მაგრამ მსგავსი მასების მქონე ელემენტები.
როგორ განვითარდა ეს ცოდნა: კონკრეტული და თანდათანობითი მოვლენები
უნდა აღინიშნოს, რომ XIX საუკუნის განმავლობაში თანდათანობით და თანდათანობით ვითარდებოდა ფიზიკისა და ქიმიის ეს თანდაყოლილი ცნებები.
უნდა ითქვას, რომ ზოგიერთ ელემენტს, როგორიცაა ვერცხლი (Ag), ოქრო (Au), სპილენძი (Cu), ტყვია (Pb) და ვერცხლისწყალი (Hg), უკვე ჰქონდათ შესანიშნავი ცოდნა უძველესი დროიდან, ელემენტის პირველი მეცნიერული აღმოჩენა მოხდა მე -17 საუკუნის განმავლობაში, როდესაც ალქიმიკოსმა ჰენინგ ბრენდმა პირველად გამოავლინა ელემენტი ფოსფორი (P)
მომდევნო საუკუნეში, ანუ მე -18 საუკუნეში დაიწყო ახალი ელემენტების ცოდნა, მათ შორის ყველაზე აქტუალური იყო გაზები, პნევმატური ქიმიის განვითარების წყალობით, ჟანგბადის (O), აზოტის (N) და წყალბადის (H) ჩათვლით.
ამ პერიოდში ფრანგმა ქიმიკოსმა ანტუან ლავუაზიემ დაწერა მარტივი ნივთიერებების სია, რომელშიც 33 ელემენტი უკვე გამოჩნდა.
მეცხრამეტე საუკუნის დასაწყისში ელექტრო ბატარეის გამოგონებამ გამოიწვია ქიმიური მოვლენების შესწავლა ახალი და ამან უფრო მეტი ელემენტის აღმოჩენა გამოიწვია, როგორიცაა ტუტე ლითონები და ტუტე-მიწიერი.
1830 წლისთვის 55 ელემენტი უკვე გამოვლენილი იყო.
მეცხრამეტე საუკუნის შუა პერიოდში, მოწყობილობის გამოგონებით, რომელსაც ეწოდება სპექტროსკოპი, უფრო მეტი ელემენტი იქნა ნაპოვნი, განსაკუთრებით იმ ფერთა ასოცირებულ ფერთან, რომლებიც წარმოადგენენ სპექტრალურ ხაზებს, მათ შორის ცეზიუმს, ტალიუმს და რუბიდიუმს დაასახელეთ რამდენიმე.
სპექტროსკოპი არის ინსტრუმენტი, რომელიც გამოიყენება ა სპექტრირადგან ეს არის რადიაციის, ბგერების ან ტალღური მოვლენების სერიის დისპერსიის შედეგი.
მსგავსებამ, რომელიც გარკვეულმა ელემენტებმა წარმოადგინეს ქიმიური და ფიზიკური თვისებების თვალსაზრისით, ზოგიერთი გამოიწვია იმდროინდელმა მეცნიერებმა გადაწყვიტეს მათი სისტემატიურად შეკვეთა, მათი გარკვეულობის მიხედვით დაჯგუფება კრიტერიუმები.
წინამორბედი ყველაზე დაშორებული, რაც გვაქვს კანონისგან, არის ცნობილი ოქტავების კანონი, შემუშავებულია ინგლისელი ქიმიკოსის ჯონ ალექსანდრე ნიულენდსის მიერ, რომელმაც შესთავაზა დიდი სიახლის გაღვიძება, რომ ყოველ რვა ელემენტს ვხვდებით მსგავსი თვისებების წინაშე.
ეს იყო დასაწყისი, რომ ჩამოეყალიბებინა საკუთარი პერიოდული ცხრილი, რომელიც ოფიციალურად გამოქვეყნდა 1863 წელს.
თითქოს ა რასის პოსტების, ამ მხრივ ხელთათმანი სხვა ქიმიკოსმა აიღო, ამ შემთხვევაში გერმანელი ჯულიუს ლოთარ მეიერი, ვინც ნიულენდსის შედეგების ამოსავალ წერტილად გამოიყენა, 1870 წელს განსაზღვრა ელემენტების ატომური მოცულობები.
მას შემდეგ რაც მან ატომური წონა გამოთვალა და შეთქმულება მოაწყო, ის შეძლებდა მსოფლიოს აჩვენოს მეცნიერება ადასტურებს, რომ ატომური წონა თვისებების ზრდას გულისხმობს ფიზიკური
და თითქმის ერთდროულად მეიერის ნამუშევრებისთვის, რუსეთში დაბადებული ქიმიკოსი დიმიტრი მენდელეევი გამოაქვეყნოს პირველი პერიოდული ცხრილი, სცემეს მეიერს, რომელიც ამას ერთი წლის შემდეგ გააკეთებდა და ამიტომ ის არის ვინც დარჩა მისი შემქმნელის დამსახურებით.
მენდელეევი დაალაგებდა ელემენტებს წესრიგის გაზრდის მიხედვით ატომური მასა რას წარმოადგენენ ისინიამასობაში, მან იმავე სვეტში მოათავსა ისინი, ვინც რაიმე მახასიათებელს იზიარებდა.
აღსანიშნავია, რომ ამ დროისთვის უკვე ცნობილი იყო 90 არსებული 90 ელემენტი.
ცხრილი დასრულდა XIX საუკუნის ბოლოს სხვა ჯგუფთან ერთად, რომელსაც ნულს უწოდებენ და კეთილშობილი გაზებისგან შედგება.
პერიოდული სამართლის თემები