분자 기하학의 정의
잡집 / / January 11, 2022
개념적 정의
공간에서 그것을 구성하는 원자의 3차원 배열을 결정하는 것은 분자의 구조입니다.

화학 공학 기술자
분자 기하학은 현재 다음을 기반으로 정의됩니다. 이론 발렌시아층(TRPECV)의 전자쌍 반발. 이 이론은 행동을 예측할 수 있습니다. 화학적 인 물질(특히 공유결합)을 이해하는 데 도움이 됩니다. 분포 로 이어지는 전자 제품 기하학 의 분자. 이것은 차례로 물질이 획득하는 많은 속성을 이해할 수 있게 해줍니다.
이 이론은 우리가 검토하고 그것들을 이해하려고 노력할 일련의 기본 기둥을 기반으로 합니다. 애플리케이션 관행. 우선, 결합 및 비결합(가전자) 전자는 다음과 같은 전자 바다로 생각됩니다. 같은 종류의 전하를 띠고 있으면 서로 반발하기 때문에 항상 원자의 중심에서 멀리 떨어져 있게 됩니다. 분자.
둘째, 이 전자의 "바다" 또는 "전자 구름"은 높은 전자 밀도 영역을 형성합니다. 전자가 공유되거나 공유되지 않는 전자 쌍으로 결합으로 구성됩니다. 차례로, 형성된 결합은 단일, 이중 또는 삼중일 수 있습니다.
마지막으로 결정하다 분자 기하학, 그것은 중심 원자 주위의 전자 밀도의 양이 계산되고 이것은 다음을 줄 것입니다 루이스 구조를 갖는 것은 매우 유용합니다 표시 기하학의 이름과 분자가 3차원적으로 취하는 모양에서 유래합니다.
이러한 밀도는 가장 안정적인 구조를 채택하고 반발이 적은 곳에 가능한 한 멀리 위치해야 한다는 점에 유의해야 합니다. 이것은 먼저 전자 기하학을 식별한 다음 분자 기하학을 식별하는 방법입니다.
6단계 밀도
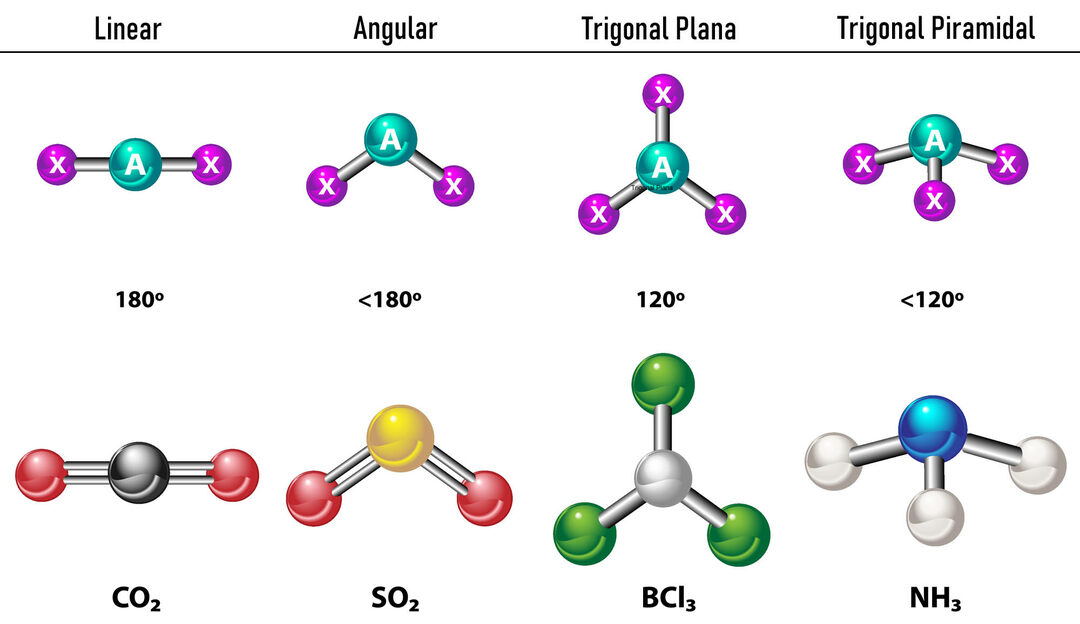
중심 원자 주위에 두 개의 전자 밀도가 있는 경우 결합은 최대한 멀리 떨어져 위치합니다. 그들 사이, 즉 서로 180º이므로 전자 기하학은 선형이고 분자 면에서도 선형입니다.
중심 원자 주위에 3개의 전자 밀도가 있는 경우 3개의 결합 또는 2개의 결합과 1개의 결합되지 않은 쌍의 두 가지 옵션이 있습니다. 3개의 결합이 있는 경우 전자 기하학은 다음과 같습니다. 삼각 플랫, 결합과 분자 기하학 사이의 각도가 120º인 은 동일한 이름을 사용합니다. 이제 결합되지 않은 쌍이 있으면 더 많이 서로를 밀어냅니다.
강함 따라서 결합 전하는 결합 각도를 압축하는 경향이 있습니다. 자유 쌍과 각 결합 사이의 각도는 120º이고 전자 기하학은 삼각 평면이고 분자 기하학은 각입니다.중심 원자 주위에 4개의 전자 밀도가 있는 경우 전자 기하학은 사면체입니다. 네 쌍의 전자가 모두 결합되어 있으면 분자 기하학은 전자 기하학과 이름이 일치하고 결합 각도는 109.5º입니다. 이제 쌍 중 하나가 자유로우면 결합각이 더 작아지고(107º) 분자 기하학은 다음과 같습니다. 삼각 피라미드. 마지막으로 두 개는 자유 쌍이고 두 개는 결합되어 있는 경우 결합각은 104.5º이고 분자 기하학은 다음과 같습니다. 모난.
중심 원자 주변의 전자 밀도가 5가 될 때 이를 a라고 합니다. 삼각 쌍뿔 전자 기하학. 모든 하중이 연결되면 적도에 위치한 링크 사이에는 120ºC의 각도가 있고 적도 링크와 축 방향 사이에는 90º의 각도가 있습니다. 이제 분자 기하학은 Trigonal Bipyramid라고도 불리는 반면 4개의 연결된 쌍과 1개의 자유 쌍이 있는 분자 기하학은 잘 알려진 "흔들리는 것", 획득한 이름은 왜곡된 사면체. 반면에 5쌍의 전자 중 2쌍이 자유롭고 그 중 3쌍이 결합되어 있으면 "T"자 모양의 기하학을 가지며 그 이름은 정확히 그 구조 때문입니다. 마지막으로, 반대의 경우 세 개의 자유 쌍과 두 개의 결합 전하를 띠면 분자 기하학이 선형입니다.
마지막으로, 중심 원자 주위에 6개의 전자 밀도가 있고 팔면체가 형성되므로 전자 기하학에서 그 이름이 지정됩니다. 유사하게, 분자 기하학은 모든 쌍이 연결되어 있으면 명명됩니다. 5개의 연결된 쌍과 1개의 자유 쌍이 있는 경우 분자 기하학은 Square Base Pyramid입니다. 4개의 결합 쌍과 2개의 자유 쌍이 있는 경우 분자 기하학은 다음과 같습니다. 스퀘어 플랫.
그림: 달콤한 자연
분자기하학 주제


