펩티드 결합 예
화학 / / July 04, 2021
그만큼 펩티드 결합 하나입니다 두 개의 아미노산 분자가 축합에 의해 결합 됨.
펩티드 결합을 더 잘 이해하려면 먼저 아미노산을 정의해야합니다.
그만큼 아미노산은 유기 분자입니다 적어도 포함하는 짧은 아미노기 (-NH2), 알칼리성, 및 카르복실기 (-COOH), 성격이 산성.
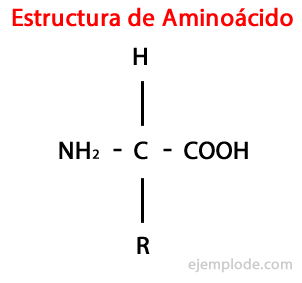
생물은 다양한 목적을 위해 매우 다양한 유형의 아미노산을 합성하지만 가장 중요한 것은 단백질의 일부이고 모두의 클래스에 속합니다 α- 아미노산.
α- 아미노산은 α 탄소라고 불리는 동일한 탄소 원자에 부착 된 산 및 아미노기를 갖는 특징이 있습니다. 또한, 이 α 탄소는 세 번째 치환기로서 수소 원자와 결합하고 치환기, 다양한 크기 및 특성의 추가 그룹으로 각 아미노산을 기타.
네 번째 치환기는 사이드 체인 아미노산의 일부이며 종종 문자 R로 단순화 된 형태로 표시됩니다.
α- 탄소의 4 개의 치환기가 다르고 그 주위에 4 면체 배열을 채택하기 때문에 α- 아미노산이 존재합니다. 광학 이성질체, 분자가 대체 형태 그것은처럼 보인다 미러 이미지 그의, 결국 동일한 분자가 아닙니다. 이 두 가지 이성체 형태의 분자에는 치환기가 공간에서 어떻게 배열되는지에 따라 문자 D 또는 L이 지정됩니다. 단백질에있는 모든 아미노산은 L입니다.
아미노산은 화학적 특성에 따라 분류됩니다. 극성 및 무극성. 차례로 Polars는 중립 및 충전 (산성 또는 염기성 일 수 있음). 그만큼 비극성은 지방족 또는 방향족 일 수 있습니다..
펩티드와 펩티드 결합
펩티드는 아미드 결합을 통한 아미노산의 공유 결합의 산물로, 한쪽의 카르 복실 말단과 다른 쪽의 아미노 말단의 축합, 물 분자를 방출 반응. 이 결합을 Peptide Bond라고합니다.
이 반응의 메커니즘은 다음과 같습니다. 아미노 및 카르복실기, 아미노산 분자의 축합이 일어나 펩타이드를 형성합니다.
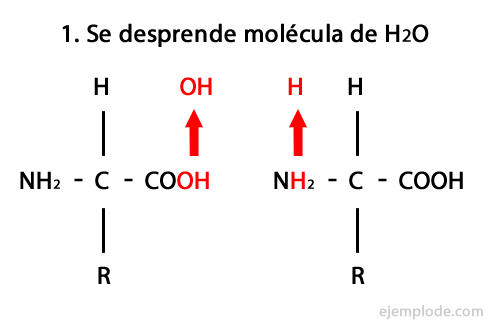
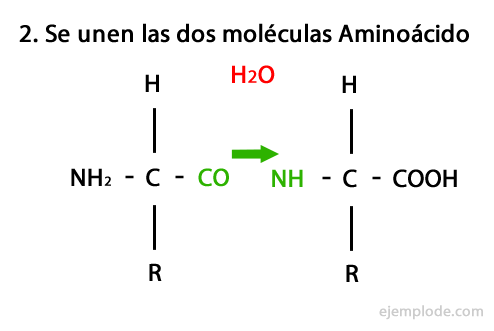

아미노산과 단백질과 같은 펩타이드는 말단에 아미노기와 카르복실기가 있습니다. 반응하지 않고.
간단한 펩타이드의 공식을 지정하려면 단백질을 구성하는 아미노산을 나열하는 것으로 충분합니다. 무료 아미노 그룹이있는 것부터, 그리고 자유 Carboxyl 그룹으로 끝납니다.
신체에서 발견되는 일부 펩티드는 바소프레신, 혈압을 높이고 신장의 수분 재 흡수를 증가시킵니다. 그만큼 엔케팔린, 통증의 감각을 감소시킵니다. 그리고 옥시토신, 이로 인해 자궁이 수축됩니다.
펩티드 결합 특성
한 아미노산의 아미노기와 다른 아미노산의 카르복실기의 축합, 수성 용매에서 발생, 그래서 그것은 자발적이지 않다따라서 단백질 합성에는 에너지 공급이 필요합니다.
아미드 결합과 마찬가지로 펩티드 결합은 두 가지 극단적 인 형태 사이의 공명: 중립적 인 형태, 첫 번째 아미노산의 카르 보닐 탄소와 두 번째 (C-N)의 아미노 질소를 연결하는 단일 결합 요금 분리 형식 여기서 두 원자는 이중 결합으로 연결됩니다 (C = N). 실제로 펩타이드 결합은 두 가지 극단적 인 상황 중 하나를 채택하지 않지만 둘 다의 공명 하이브리드입니다.
전화가 있습니다 펩티드 비행기, 구성 두 개의 초기 아미노산을 연결하는 펩티드 결합에 관련된 모든 원자. 한편으로 질소와 수소의 원자는 첫 번째 아미노산에 각각 탄소 α가 있습니다. 다른 한편으로, 다른 아미노산의 탄소 α, 카르보닐기의 산소 및 탄소.
펩티드와 단백질의 차이점
그만큼 펩타이드에는 아미노산 수가 적습니다., 그 범위는 2 개에서 수십 개에 이르며 솔루션의 형태는 유연 해집니다.
그만큼 작은 단백질, 구조적으로 큰 펩타이드에 가깝고 정의 된 형태와 훨씬 덜 유연함.
펩티드와 같이 무질서하고 유연한 형태를 가진 단백질이 있지만, 세포의 다른 거대 분자와 상호 작용할 때 순서가 있습니다.
펩타이드 결합에 참여하는 아미노산의 20 가지 예
- 등나무
- 소녀에게
- 발린
- 류신
- 이소류신
- 프롤린
- 메티오닌
- 페닐알라닌
- 티로신
- 트립토판
- 세린
- 트레오닌
- 시스테인
- 아스파라긴
- 글루타민
- 아스파르트 산
- 글루탐산
- 라이신
- 아르기닌
- 히스티딘