Cheminių reiškinių pavyzdys
Chemija / / July 04, 2021
Chemija tiria medžiagos komponentus, jų sudaromus junginius ir galimus jų derinius produktai, atsirandantys dėl šių derinių, ir jų struktūra, bei juos sukeliantys, pagreitinantys ar sulėtinantys reiškiniai modifikacijos. A Cheminis reiškinys yra toks, kai dvi ar daugiau medžiagų pasikeičia ir keičia jų vidinę struktūrą, sukeldamos vieną, dvi ar daugiau medžiagų, skiriasi nuo pradinės medžiagos.
Skirtingai nuo fizinių reiškinių, kai kai kurios daiktų savybės yra pakeistos, tačiau jie visada yra ta pati substancija arba junginys, fiziniuose reiškiniuose keičiasi medžiagų struktūra, dėl to lieka kitos medžiagos, kitokios nei originalus. Tai reiškia, kad visi cheminiai reiškiniai yra cheminės reakcijos, dėl kurių atsiranda viena ar kelios medžiagos, kurios molekuliniu požiūriu skiriasi nuo pradinės medžiagos ar medžiagų.
Cheminių reiškinių tipai:
Cheminius reiškinius pagal rezultatą galima klasifikuoti taip:
Sintezė
Du ar daugiau junginių susijungia ir sudaro sudėtingesnį junginį.
Skilimas
Sudėtingas junginys suyra ir susidaro paprastesnės molekulės.
Poslinkis
Vienas iš reaguojančių molekulių elementų arba radikalas tampa kitos molekulės, su kuria jis reaguoja, dalimi.
Dvigubas slinkimas
Reaguojančios molekulės keičia elementą arba radikalą, todėl atsiranda dvi skirtingos molekulės, į kurias jos reagavo.
Kalbėdami apie reakcijas kaip apie cheminius reiškinius, galime paminėti šiuos dalykus:
Oksidacija
Oksidacija yra reakcija, kurios metu deguonis susijungia su kitu elementu, suteikdamas oksidą, jei tai metalai, ir oksio rūgštį, jei jis susijungia su nemetaliniais elementais. Reakcija yra lėta ir medžiagos temperatūra nepakyla.

Degimas
Degimas yra greito oksidacijos forma, kurios metu taip pat skleidžiama šviesa ir šiluma, tai yra, egzogeninė reakcija.
Šarminimas
Tai yra, kai metalas jungiasi su hidroksilo radikalu (radikalas su -OH forma).
Rūgštinimas
Tai yra tada, kai nemetalinis elementas sujungiamas su vandeniliu
Neutralizavimas
Tai yra hidroksido ir rūgšties derinys, dėl kurio susidaro vanduo ir druska.
Redukcija
Tai yra deguonies pašalinimas iš oksido, norint gauti gryną metalą, reaguojant su vandeniliu iš rūgšties.
Jonizacija
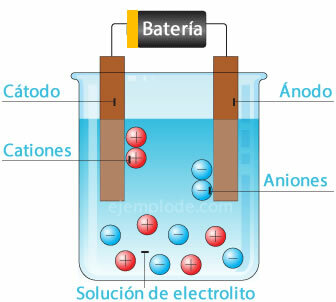
Tirpinant druską vandenyje, ją sudarantys elementai yra padalijami į atomus su elektriniais krūviais, kurie gali būti teigiami (katijonai) arba neigiami (anijonai). Tokio tipo tirpalai vadinami elektrolitais.
Elektrolizė
Kai elektros srovė praeina per elektrolitą, dėl elektros atomai atitrūksta nuo vandens. vandenilio jonas, turintis teigiamą krūvį, einantis į neigiamą polių (katodą), ir deguonis, turintis neigiamą krūvį, einantis į polių teigiamas (anodas). Taikant elektrolizę rūgštyje, vienas iš jų yra metalinio elemento išstūmimas į anodą.
Katalizė
Į jį gali reaguoti dvi medžiagos, kurios, esant bendroms sąlygoms, nereaguoja arba veikia labai lėtai labai greitai, esant trečiajai medžiagai, kuri nepasikeis nei prieš, nei jos metu reakcija. Šio tipo medžiagos vadinamos katalizatoriais.
Fermentacija
Tai yra cheminis pokytis, ypač organiniuose junginiuose, veikiant bakterijoms.
Cheminių reiškinių pavyzdys:
1. Nedažyta kepsninė turės sąlytį su ore ir vandenyje esančiu deguonimi ir pradės rūdyti (oksiduotis).
2. Priartinus medieną prie ugnies, ji degs, sukeldama kai kurias anglies molekules, kurios ją sudaro greitai sumaišykite su deguonimi, išskirdami anglies dioksidą, palikdami degintą medieną ir suodžius (degimas)
3. Maisto skaidymas atsiranda dėl bakterijų virškinimo, pakeičiančio komponentų cheminę struktūrą. (Fermentacija).
4. Automobilio akumuliatorius gamina elektrą, reaguodamas tarp elektrolito ir metalinių elementų, su kuriais jis susidaro, sukeldamas jonus, kurie gamina elektrą. Norėdami jį įkrauti, srovės srautas atlieka elektrolitinį veiksmą, kuris grąžina jonus į plokštes.
5. Automobilio variklio gaminamos dujos yra stabilios ir beveik nesuyra išėjus iš variklio ir pasiekus kambario temperatūrą. Katalizatoriuje yra platinos putos, kurios, kaitinant maždaug iki 500 ° C, leisti dujoms suskaidyti į paprastesnius junginius, be platinos modifikacijos.
6. Tirpindama druską vandenyje, ji skyla į natrio ir chloro jonus.
7. Putos, atsirandančios sumaišius citrinos sultis su soda, yra neutralizavimo reakcija.
8. Kai kraujuojame, kraujas įgauna tamsesnę spalvą dėl raudonosiose kraujo ląstelėse esančios geležies oksidacijos. Štai kodėl veninis kraujas yra tamsesnis, o arterinis - ryškesnis.
9. Chromuojant automobilių detales, atliekant elektrolizę, chromas nusodinamas ant metalinės dalies, kuri yra chromuojama.
10. Virškinant kaip cheminį reiškinį, druskos rūgšties poveikis maistui yra suskaidyti Juos sudarančios kompleksinės molekulės į mažesnes molekules, kurias galima lengviau absorbuoti į žarnynas.