Aromatinių junginių pavyzdys
Chemija / / July 04, 2021
Chemikai nustatė, kad naudinga visus organinius junginius skirstyti į dvi plačias klases: junginius Alifatinis ir junginiai Aromatika. Aromatiniai junginiai yra benzenas ir panašaus cheminio elgesio junginiai. Aromatinės savybės išskiria benzeną iš alifatinių angliavandenilių. Benzeno molekulė yra tam tikro tipo žiedas. Yra ir kitų junginių, taip pat žiedo formos, kurie struktūriškai skiriasi nuo benzeno ir vis dėlto elgiasi panašiai.
Pasirodo, kad šie kiti junginiai savo elektroninėje struktūroje yra panašūs į benzeną, todėl jie taip pat elgiasi kaip aromatiniai.
Alifatiniai angliavandeniliai (alkanai, alkenai, alkinai ir jų cikliniai analogai) daugiausia reaguoja papildymas, keliose nuorodose ir laisvųjų radikalų pakeitimas, kituose alifatinės grandinės taškuose.
Kita vertus, aromatiniams angliavandeniliams pabrėžiama, kad jie yra linkę heterolizinis pakaitalas. Be to, tos pačios pakaitų reakcijos būdingos aromatiniams žiedams, kad ir kur jie atsirastų, neatsižvelgiant į tai, kokių dar funkcinių grupių molekulėje gali būti. Pastarosios grupės veikia aromatinių žiedų reaktyvumą ir atvirkščiai.
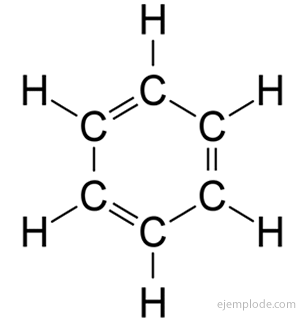
Benzeno molekulė
Benzenas buvo žinomas nuo 1825 m., O jo cheminės ir fizinės savybės yra geriau žinomos nei bet kurio kito organinio junginio. Nepaisant to, patenkinama struktūra buvo pasiūlyta tik 1931 m užtruko iki 15 metų, kol jis buvo plačiai naudojamas tarp chemikalų ekologiškas. Sunkumai kilo dėl plėtros, kurią struktūrinė teorija jau pasiekė, ribotumo. Galutinė struktūra buvo pasiekta darant prielaidą apie keletą svarbių faktų:
Benzenas turi molekulinę formulę C6H6. Dėl elementinės sudėties ir molekulinės masės buvo žinoma, kad benzenas turi šešis anglies ir šešis vandenilio atomus. Problema buvo žinoti tokių atomų išsidėstymą.
1858 m. Augustas Kekulé pasiūlė anglies atomus susieti ir sudaryti grandines. Vėliau, 1865 m., Jis pasiūlė atsakymą į benzeno problemą: šias karbonato grandines kartais galima uždaryti, kad būtų suformuoti žiedai.
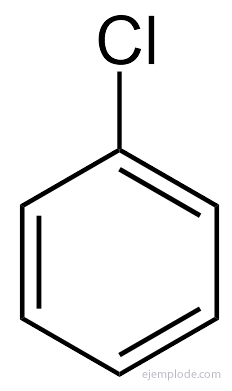
Benzenas suteikia tik vieną pakaitą turinčią produktą C6H5Y. Pvz., Kai vandenilio atomą pakeičia bromas, gaunama tik viena brombenzeno C konfigūracija.6H5Br; analogiškai gaunamas ir chlorbenzenas C6H5Cl arba nitrobenzenas C6H5NE2ir kt. Šis faktas labai riboja benzeno struktūrą: visas jo vandenilis turi būti lygiaverčiai, tai yra, jie visi turi būti sujungti su anglimis, kurios savo ruožtu yra vienodai susieta. CH vandenilio negali būti3ir kiti CH2ir kiti CH. Galutinė monopakeisto struktūra turėtų būti tokia pati, kad bet kuris vandenilis būtų pakeistas benzene.
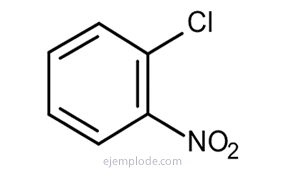
Benzenas suteikia tris izomerinius pakaitinius produktus, C6H4Y2 arba C6H4IR Z. Yra tik trys izomeriniai DiBromoBenzenai, C6H4Br2, trys chloro nitrobenzenai C6H4ClNO2ir kt. Šis faktas dar labiau apriboja struktūrines galimybes.
Benzenas vykdo pakaitines, o ne adityvines reakcijas. Kekulé benzeno struktūra atitinka tą, kurią pavadintume cikloheksatrienu. Dėl to jis turėtų lengvai reaguoti pridėdamas, kaip ir panašūs junginiai - cikloheksadienas ir cikloheksenas, kuris yra būdingas alkenų struktūrai. Bet taip nėra; tokiomis sąlygomis, kai alkenai greitai reaguoja, benzenas nereaguoja arba veikia labai lėtai. Vietoj pridėjimo reakcijų benzenas lengvai vykdo reakcijų rinkinį, kuris visas yra pakeitimas, kaip Nitratavimas, Sulfonavimas, Halogeninimas, Friedelio-Craftso alkilinimas, Acilinimas nuo Friedel-Crafts. Kiekvienoje iš šių reakcijų atomas ar grupė buvo pakeisti vienu iš benzeno vandenilio atomų.
Benzeno stabilumą lemia besikeičiančios dvigubos jungtys ir rezonansinė energija ta, kurioje dvigubos jungtys pakeičia anglies padėtį, išlaikydamos tą pačią kaitą struktūrinis. Yra rezonanso stabilizavimo energija yra atsakingas už vadinamųjų savybių rinkinį Aromatinės savybės.
Papildymo reakcija paverčia alkeną stabilesniu sočiuoju junginiu. Bet benzeno atveju, papildymas daro jį mažiau stabilų, sunaikindamas rezonanso palaikomą ir stabilizuotą žiedo sistemą. Galutinė molekulė būtų cikloheksadienas. Dėl šio fakto benzolo stabilumas lemia tik pakaitų reakcijas.
Aromatinių junginių savybės
Be medžiagų, kuriose yra benzeno žiedų, yra daugybė kitų, kurios laikomos aromatingomis, nors iš esmės jos beveik nepanaši į benzeną.
Eksperimentiniu požiūriu aromatiniai junginiai yra medžiagos, kurių molekulinės formulės rodo a didelis nesočiųjų laipsnis, nepaisant to jie yra atsparus papildymo reakcijoms taip būdinga nesočiųjų junginių.
Vietoj to, šie aromatiniai junginiai a dažnai vyksta elektrofilinės pakaitinės reakcijos panašus į benzolo. Kartu su šiuo pasipriešinimu pridedant ir tikriausiai dėl to yra įrodymų, kad a neįprastas stabilumas, pavyzdžiui, žemas hidrinimo ir degimo karštis.
Aromatinės medžiagos yra ciklinės, paprastai pateikiantys penkių, šešių ir septynių atomų žiedus, o jų fizinis patikrinimas rodo, kad jie turi plokščios arba beveik plokščios molekulės. Jo protonų branduolinio magnetinio rezonanso spektruose yra tas pats cheminis poslinkis, kaip benzene ir jo dariniuose.
Teoriniu požiūriu, kad medžiaga būtų aromatinė, jos molekulėje turi būti cikliniai delokalizuotų π elektronų debesys virš ir žemiau molekulės plokštumos; Be to, šiuose π debesyse turi būti iš viso (4n + 2) π elektronų; tai reiškia, kad delokalizacijos nepakanka, kad gautųsi aromatinį junginį apibūdinantis stabilumas.
Benzeno darinių (aromatinių junginių) nomenklatūra
Daugelio šių darinių atveju, ypač turinčių vieną pakaitalą, pakanka nurodyti pavadinimą žodžio benzenas pakaitinė grupė, pavyzdžiui, chlorbenzenas, brombenzenas, jodo benzenas, Nitrobenzenas.
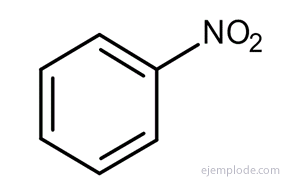
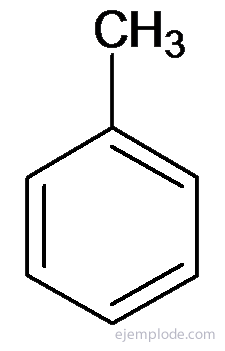
Kiti dariniai turi specialius pavadinimus, kurie gali nebūti panašūs į pakaitų grupės pavadinimą. Pavyzdžiui, metilbenzenas yra žinomas tik kaip toluolas; Aminobenzenas kaip anilinas; Hidroksibenzenas kaip fenolis ir kt.
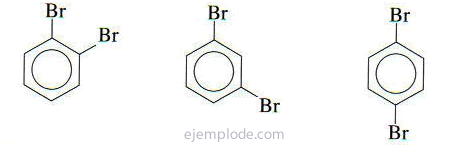
Jei prie benzeno žiedo yra dvi grupės, būtina ne tik nustatyti, kokie jie yra, bet ir nurodyti jų santykinę vietą. Trys galimi pakaitų benzolų izomerai apibūdinami priešdėliais orto, meta ir para, sutrumpintai o-, m-, p-. Pavyzdžiui: o-DiBromoBenzenas, m-DiBromoBenzenas, p-DiBromoBenzenas.
Jei viena iš dviejų grupių yra tokio tipo, kuri suteikia molekulei specialų pavadinimą, junginys įvardijamas kaip tos specialiosios medžiagos darinys. Pvz.: nitrotoluolas, bromfenolis ir kt.
Aromatinių junginių pavyzdžiai
Toluolas arba metilbenzenas
Etilbenzenas
Izopropilbenzenas
TriNitroToluene arba TNT
Anilinas arba aminobenzenas
Benzenkarboksirūgštis
Glutamo rūgštis arba Para-amino-benzenkarboksirūgštis
Tolueno sulfonrūgštis
Fenolis arba hidroksibenzenas
Bromfenolis
Trichlorbenzenas
Benzeno fenilo eteris
Jodo benzenas
Brombenzenas