20 Ķīmisko parādību piemēri
Miscellanea / / July 04, 2021
The ķīmiskās parādības (vai ķīmiskās reakcijas) ir tās parādības, kurās matērijā notiek izmaiņas, un rodas jaunas vielas, ko sauc par "produktiem", un citi, ko sauc par "reaģentiem", sadalās. Piemēram: koksnes puve, papīra dedzināšana, kompostēšana.
Ķīmiskās reakcijas var būt spontāns (reakcijas, kas notiek bez enerģijas vai katalizatoru nepieciešamības) vai nav spontāns (reakcijas, kurām nepieciešams enerģijas ieguldījums, katalizatori vai kāda ārēja iejaukšanās). Daudzas reizes, lai notiktu reakcija, reaģentiem ir jābūt a temperatūra specifisks, a pH iestatītā spiediena vērtība utt.
Var būt arī svarīgi kontrolēt ātrums uz kurām notiek ķīmiskās reakcijas. The katalizatori Tās ir vielas, kuras pievieno ķīmiskai reakcijai, lai palielinātu tās ātrumu, savukārt inhibitori ir vielas, kas palēnina ķīmisko reakciju ātrumu. Citi faktori, kas ietekmē ķīmiskās reakcijas ātrumu, ir temperatūra, spiediens, reaģentu koncentrācija un pašas reakcijas raksturs.
Tas var kalpot jums:
Ķīmisko parādību veidi
Ķīmiskās reakcijas var būt:
Neorganiskas reakcijas. Iejaukties neorganiskie savienojumi un to var klasificēt pēc:
- Jēga, kādā notiek reakcija.
-
Atgriezeniskas reakcijas. Tie notiek abos veidos, tāpēc produkti var sadalīties un atkal veidot reaģentus.
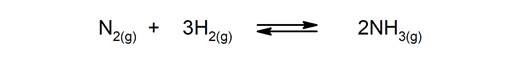
-
Neatgriezeniskas reakcijas. Tās notiek tikai vienā veidā.

-
Atgriezeniskas reakcijas. Tie notiek abos veidos, tāpēc produkti var sadalīties un atkal veidot reaģentus.
- Daļiņas veids, kas reaģē.
-
Skābju bāzes reakcijas. Notiek H jonu pārnese+.

-
Oksidēšanās-reducēšanās reakcijas. Viens no reaģentiem oksidējas (palielina tā daudzumu) oksidēšanās), bet otrs ir samazināts (tā oksidācijas skaits samazinās). Šajās reakcijās notiek elektronu pārnese.

-
Skābju bāzes reakcijas. Notiek H jonu pārnese+.
- Reakcijas ātrums.
-
Ātras reakcijas. Tie rodas ļoti īsā laikā.
-
Lēnas reakcijas To pabeigšana prasa ilgu laiku.
-
Ātras reakcijas. Tie rodas ļoti īsā laikā.
- Enerģijas forma, ko tā izstaro vai absorbē.
-
Eksotermiskas reakcijas. To rašanās laikā tie atbrīvo siltumu.
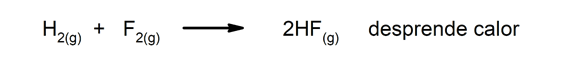
-
Endotermiskas reakcijas. Kad tie notiek, tie absorbē siltumu.

-
Eksolumīniskas reakcijas. Kad tie notiek, tie izstaro gaismu.

-
Endoluminous reakcijas. Lai notiktu, viņiem vajag gaismu.

-
Eksotermiskas reakcijas. To rašanās laikā tie atbrīvo siltumu.
- Transformācijas veids.
-
Sintēzes vai pievienošanas reakcijas. Divas vielas apvienojas, veidojot jaunu vielu.
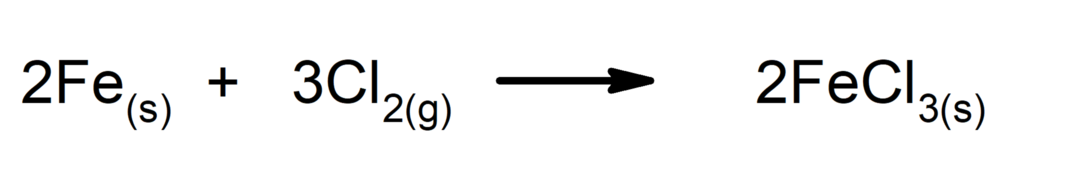
-
Sadalīšanās reakcijas. Viena vai vairākas vielas sadalās to vienkāršākajās sastāvdaļās.
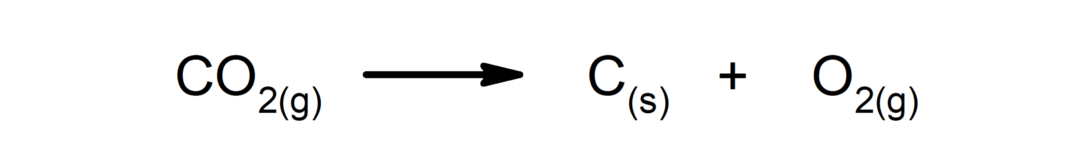
-
Pārvietošanas vai aizstāšanas reakcijas. Viens elements vai savienojums savienojumā aizstāj citu, atbrīvojot to.
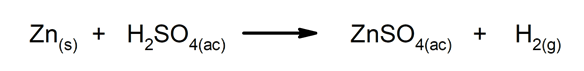
-
Divkāršās aizstāšanas reakcijas. Divi savienojumi vienlaikus apmainās ar elementiem vai savienojumiem.

-
Sintēzes vai pievienošanas reakcijas. Divas vielas apvienojas, veidojot jaunu vielu.
Organiskās reakcijas. Tās ir reakcijas, kurās iejaucas organiskie savienojumi. Viņiem ir daudz klasifikāciju, pamatojoties uz reaģējošā organiskā savienojuma veidu un tā reakcijas veidu. Daži piemēri:
-
Alkānu halogenēšana. Ūdeņradis ir aizvietots ar alkāns ar halogēnu.
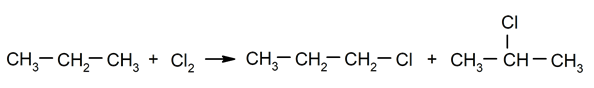
-
Alkānu sadedzināšana. Alkāns, reaģējot ar skābekli, rada oglekļa dioksīdu un ūdeni, ja degšana ir pabeigta.
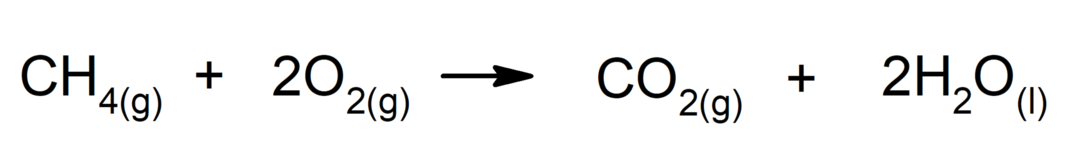
-
Halogenēšana alkēni. Halogēnus aizstāj ar vienu vai abiem ogļūdeņražiem, kas ir saistīti ar dubulto saiti.
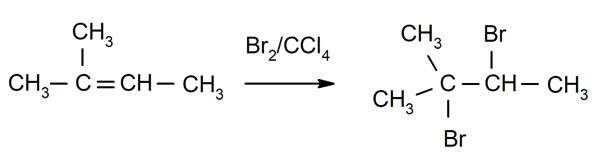
-
Alkēnu hidrogenēšana. Ūdeņražiem pievieno ogļūdeņražus, kas iesaistīti divkāršajā saitē, veidojot atbilstošo alkānu.
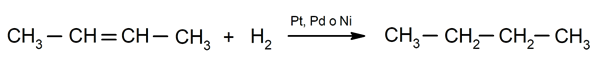
Ķīmisko parādību nozīme
Daudzas ķīmiskas parādības uzturēt dzīvi dzīvām būtnēm, piemēram, gremošanu cilvēkiem un dzīvnieki, fotosintēze augos un elpošana abos.
Vēl viens ļoti svarīgs ķīmiskais process, īpaši mikroorganismi, ir fermentācija, ko parasti izmanto ēdiens piemēram, sieri, jogurti, vīni un alus.
Visi palielināt un izaugsmi gada a dzīva būtne Tas ietver tajā notiekošās ķīmiskās reakcijas, kuras dažkārt stimulē noteikti vides apstākļi.
Ķīmisko parādību piemēri
Ap mums ir daudz ķīmisko parādību vai procesu gadījumi, kas tos ietver:
- Koka puve
- Sadegšana papīra
- Izturība pret antibiotikas baktērijas
- Piens, kas kļūst skābs
- Dezinficē brūci ar alkohols
- Augļu sāls lietošana, lai cīnītos ar grēmas
- Sveces dedzināšana
- Asins sarecēšana
- Muskuļu nogurums pēc intensīvas slodzes
- Nāve kukaiņi ar insekticīdiem
- Rokforas siera iegūšana
- Sidra iegūšana
- Jogurta iegūšana
- Kompostēšana
- Silāža
- Bioetanola iegūšana no melases
- Pietūkušas skārda kārbas
- Sapuvusi ola
- Režģa rūsēšana
- Biodīzeļdegvielas iegūšana no palmu eļļas
Ķīmiskās parādības rūpniecībā
Atsevišķas ķīmiskās parādības ir arī galvenāsrūpniecībā. Pirmkārt, sadedzināšana ogļūdeņraži (piemēram, benzīns, dīzeļdegviela vai petroleja) ražo Enerģija vadīt mašīnas, kas apstrādā neskaitāmus rūpnieciskos procesus.
No otras puses tērauda rūpniecība, papīrs, plastmasa, celtniecības materiāli, krāsas, narkotikas, izstrādājumi agro utt., balstās uz dažādām ķīmiskām parādībām, piemēram, cinkošanu, elektrolīzi un daudzām citām citi vairāk.
Paaudze jauni enerģijas avoti (piemēram, biodīzeļdegviela un bioetanols) pamatā ir arī šāda veida parādības.
Enerģijas pārveidošana
Ķīmiskajās parādībās parasti ir enerģijas pārveidošana. Piemēram, kad ķīmiskā enerģija, kas atrodas noteiktas molekulas saitēs, tiek pārveidota par elektrisko enerģiju vai izdalīta kā siltums (tas notiek eksotermiskās parādībās, piemēram, ja sālsskābi sajauc ar cinku), notiek Enerģija. Tas pats notiek, kad gaismas enerģija tiek uztverta un pārveidota par ķīmisko enerģiju.
Dažiem ķīmiskajiem procesiem ir nepieciešams siltums, un tos sauc par "endotermiskiem". Citi pieprasa katalizatoru vai kofaktoru klātbūtni.



