50 Aldehīdu un ketonu piemēri
Piemēri / / November 06, 2023
The aldehīdi ir organiskie savienojumi kuru struktūrā ir funkcionālā karbonilgrupa (= C = O), kas ir saistīta ar oglekļa ķēdi un ūdeņraža atomu. Piemēram: metanāls (saukts arī par formaldehīdu), etanāls (saukts arī par acetaldehīdu) un propanāls (saukts arī par propaldehīdu).
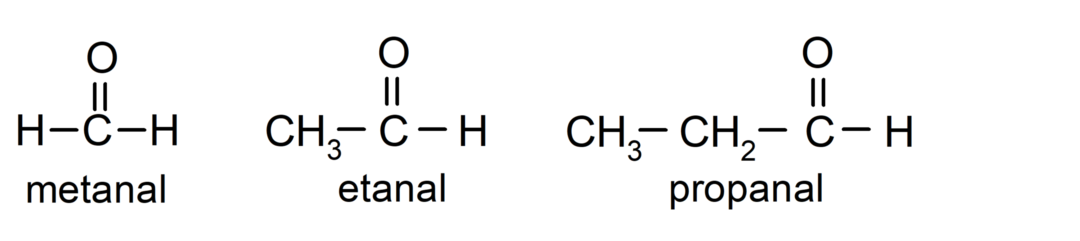
The ketoni Tie ir organiski savienojumi, kuru struktūrā ir karbonilgrupa, kas saistīta ar diviem oglekļa atomiem. Piemēram: propanons (saukts arī par acetonu), butanons un 2-pentanons.
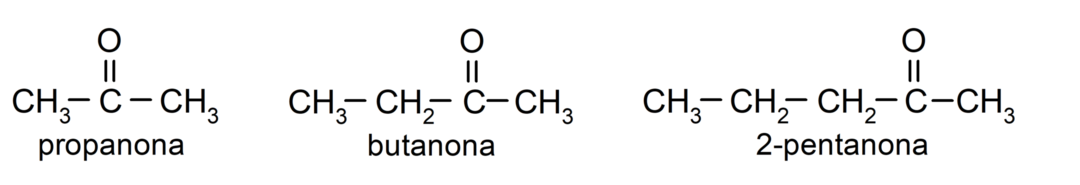
Atšķirības starp aldehīdiem un ketoniem
Galvenās atšķirības starp aldehīdiem un ketoniem ir:
- Aldehīdu struktūrā ir karbonilgrupa, kas atrodas vienā gala galā, savukārt ketoniem karbonilgrupa atrodas ne-gala pozīcijās struktūra.
- Aldehīdi tiek oksidēti, reaģējot ar Tollensa reaģentu, veidojot metālisku sudrabu. Tie arī oksidējas pret Benedikta reaģentu, veidojot vara oksīdu. Ketonus neoksidē neviens no reaģentiem.
- Aldehīdi tiek reducēti par primārajiem spirtiem, bet ketoni - par sekundārajiem spirtiem.
Fizikālās īpašības
Aldehīdu fizikālās īpašības
Aldehīdu fizikālās īpašības ir ļoti dažādas, jo tās ir atkarīgas no oglekļa ķēdes uzbūves, kas ir saistīta ar karbonilgrupu.
Daži no tiem ir:
- Aldehīdi, kas vislabāk šķīst ūdenī, ir mazāki, piemēram, metanols un etanāls.
- Gaistošiem aldehīdiem ir asa un pat kairinoša smaka.
- Karbonilgrupa tiem piešķir polaritāti.
- Parasti tiem ir augstāka viršanas temperatūra nekā līdzīga molekulārā izmēra ķīmiskajiem savienojumiem.
Ketonu fizikālās īpašības
Ketonu fizikālās īpašības ir atkarīgas no tā, kā veidojas oglekļa ķēde, kas ir saistīta ar karbonilgrupu.
- Daudziem ketoniem ir patīkama smaka.
- Tā šķīdība ūdenī ir atkarīga no karbonilgrupai pievienotās oglekļa ķēdes lieluma. Jo mazāka ir oglekļa ķēde, jo labāk šķīst ketons ūdenī.
- Karbonilgrupa tiem piešķir izteiktu polaritāti.
- Tiem ir diezgan augsta viršanas temperatūra salīdzinājumā ar ķīmiskiem savienojumiem ar salīdzināmu molekulāro izmēru.
Ķīmiskās īpašības
Aldehīdu ķīmiskās īpašības
Starp aldehīdu ķīmiskajām īpašībām mēs varam atrast:
Tie tiek oksidēti, veidojot atbilstošo karbonskābi, tas ir, izveidotajai skābei oglekļa ķēdē būs tāds pats oglekļa skaits kā aldehīds kas to izraisīja. Piemēram:
- Oksidēšana ar Tollensa reaģentu (amonija sudraba komplekss bāzes šķīdumā, [Ag (NH)3)2]+) no etanāla iegūst etānskābi un metālisku sudrabu.
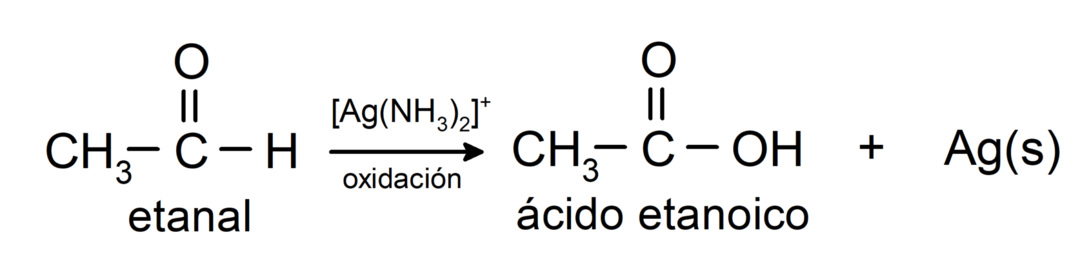
- Etanālu oksidējot ar Benedikta reaģentu (vara sulfāta sārmainu šķīdumu), veidojas etānskābe un vara oksīds.
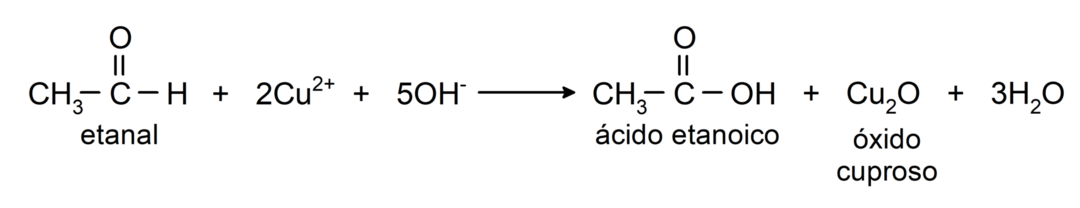
Tajos notiek nukleofīlas pievienošanās reakcijas, tas ir, nukleofila pievienošana karbonilgrupai. Piemēram:
- Ciānūdeņražskābes pievienošana, lai veidotu ciānhidrīnus vai ciānhidrīnus.
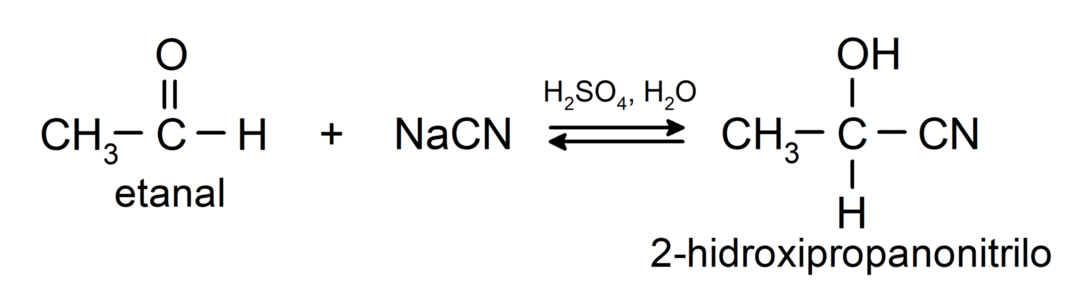
- Bezūdens skābju klātbūtnē aldehīdu karbonilgrupai pievieno spirtus, veidojot acetālus un pusacetālus.
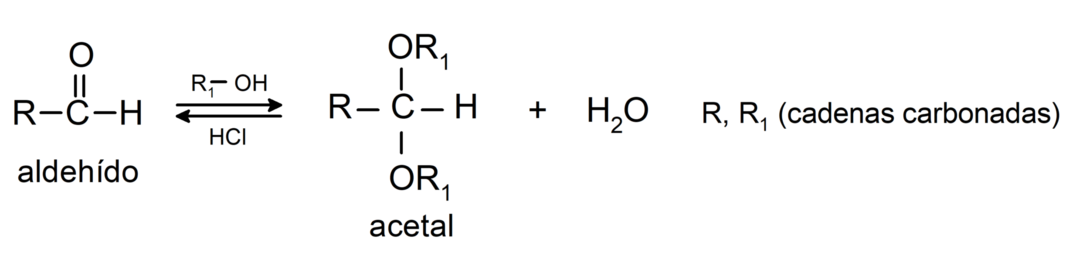
Tajos notiek aldola kondensācijas reakcijas. Šajās reakcijās divu aldehīdu savienošanās notiek nātrija hidroksīda (NaOH) un ķīmiskais savienojums iegūto sauc par aldolu. Piemēram:
- Etanāla kondensācijas reakcija atšķaidīta NaOH klātbūtnē.
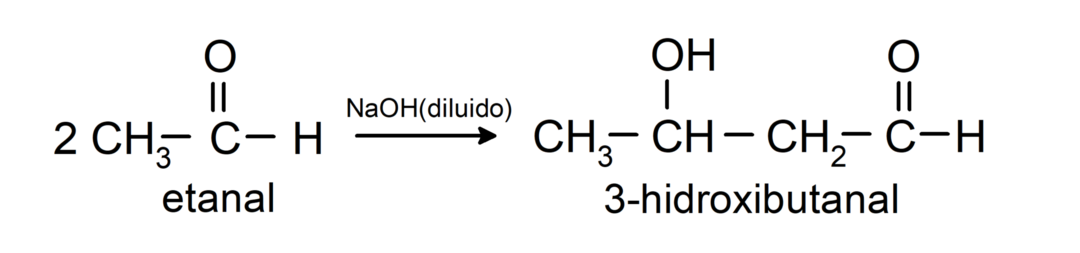
Tie tiek reducēti līdz primārajiem spirtiem. Aldehīdus var reducēt par primārajiem spirtiem ar katalītisko hidrogenēšanu vai reducēšanu ar nātrija borhidrīdu (NaBH).4) un litija alumīnija hidrīdu (LiAlH4).
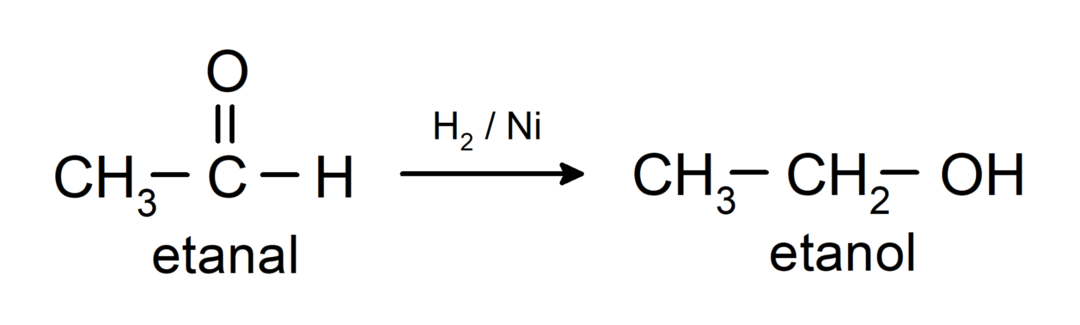
Ketonu ķīmiskās īpašības
Starp ketonu ķīmiskajām īpašībām mēs varam atrast:
Tajos notiek nukleofīlas pievienošanās reakcijas. Piemēram:
- Ciānūdeņražskābes pievienošana, lai veidotu ciānhidrīnus vai ciānhidrīnus.
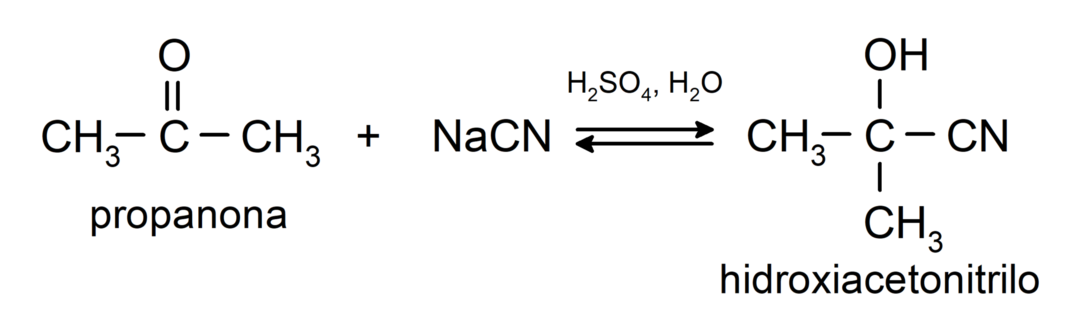
Tie pievieno spirtus (bezūdens skābju klātbūtnē) uz ketonu karbonilgrupu, veidojot ketālus un hemiketālus. Piemēram:
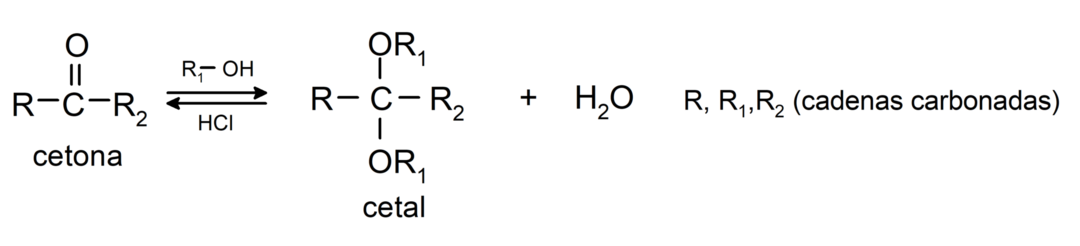
Tajos notiek halogenēšanas reakcijas. Ketoni, kuriem ir alfa ūdeņradis (α) reaģē, aizstājot šo ūdeņradi ar halogēniem (hloru (Cl), bromu (Br), jodu (I), fluoru (F)) skābes vai bāzes katalizatoru klātbūtnē. Aizstāšana notiek gandrīz tikai ar oglekli α, tas ir, ogleklis, kas ir saistīts ar ūdeņradi α. Piemēram:
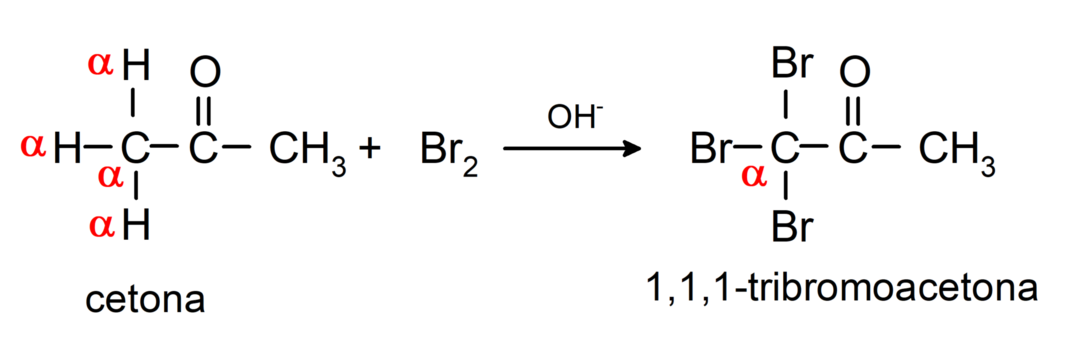
Tie tiek reducēti līdz sekundāriem spirtiem katalītiski hidrogenējot vai reducējot ar nātrija borhidrīdu (NaBH4) un litija alumīnija hidrīdu (LiAlH4). Piemēram:
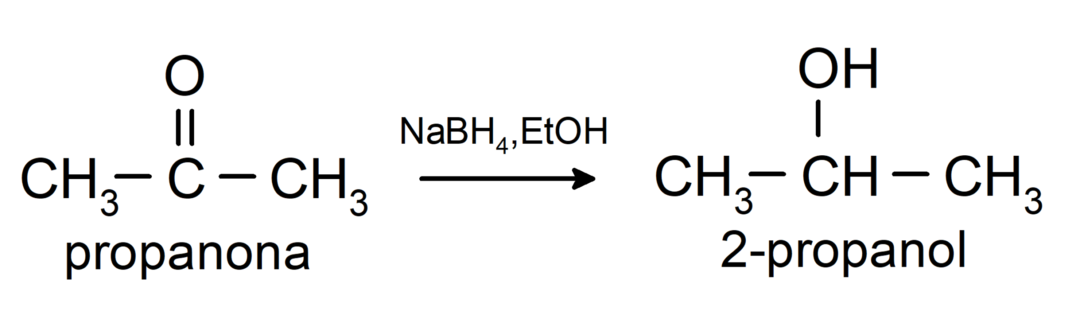
Ketonus neoksidē Tollensa un Benedikta reaģenti.
Aldehīdu nomenklatūra
Saskaņā ar Starptautiskās tīrās un lietišķās ķīmijas savienības (IUPAC) noteikumiem, Aldehīdi tiek nosaukti, izmantojot priedēkļus, kas norāda oglekļa skaitu ķēdē. gāzēts. Nav nepieciešams norādīt karbonilgrupas pozīciju, jo tā vienmēr atrodas pirmajā pozīcijā, vienā molekulas galā. Turklāt aldehīda nosaukuma beigās ir rakstīts sufikss -al. Piemēram:
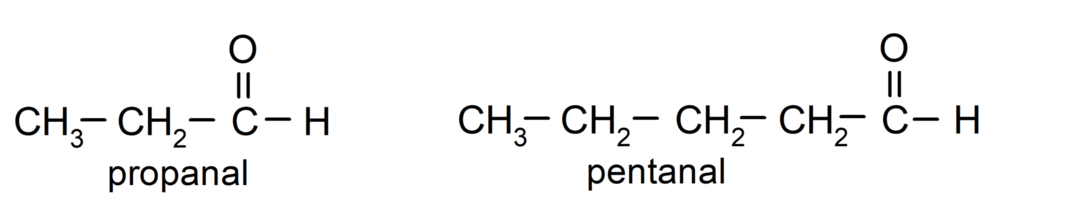
Ja aldehīds sastāv no vairākām oglekļa ķēdēm, tas ir, tam ir zari, par galveno ķēdi tiek izvēlēta oglekļa ķēde ar lielāko oglekļa atomu skaitu. Pārējās ķēdes tiek nosauktas kā aizvietotāju grupas, un katra aizvietotāja pozīcija ir izvēlēta tā, lai ķēdē tas aizņemtu mazāko iespējamo skaitu. Turklāt oglekļa atomus sāk skaitīt, sākot no gala, kurā ir karbonilgrupa. Piemēram:
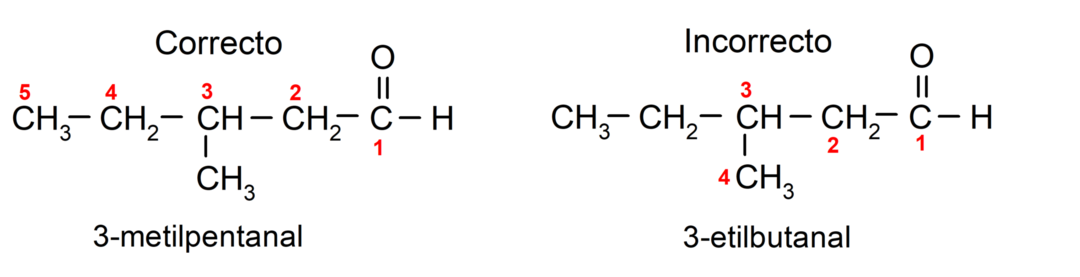
Aldehīdi, kuriem ir divas karbonilgrupas, tiek nosaukti, izmantojot sufiksu -dial. Piemēram:
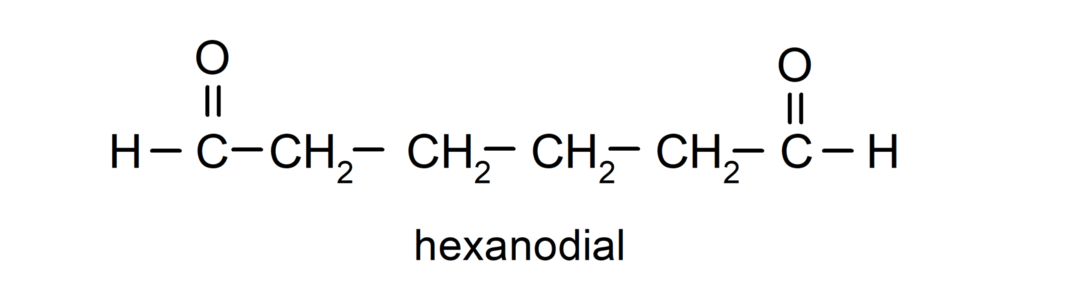
Ketonu nomenklatūra
Saskaņā ar Starptautisko tīrās un lietišķās ķīmijas savienību (IUPAC) ketoni tiek nosaukti, izmantojot priedēkļus, kas norāda oglekļa atomu skaitu oglekļa ķēdē.
No otras puses, acetona nosaukumu raksta, izmantojot sufiksu -one, pirms kura ir skaitlis, kas norāda karbonilgrupas stāvokli oglekļa ķēdē. Karbonilgrupas atrašanās vieta jāizvēlas tā, lai tā atbilstu pēc iespējas mazākai numerācijai. Piemēram:
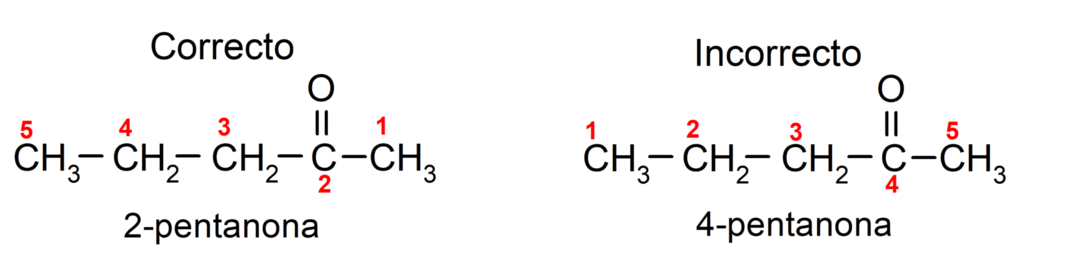
Lai nosauktu ketonu, kas sastāv no vairākām oglekļa ķēdēm, tas ir, ar zariem, mēs izvēlamies kā galvenā ķēde ir oglekļa ķēde ar lielāko oglekļa atomu skaitu un kas satur grupu karbonilgrupa. Pārējās ķēdes ir nosauktas kā aizvietotāju grupas. Piemēram:
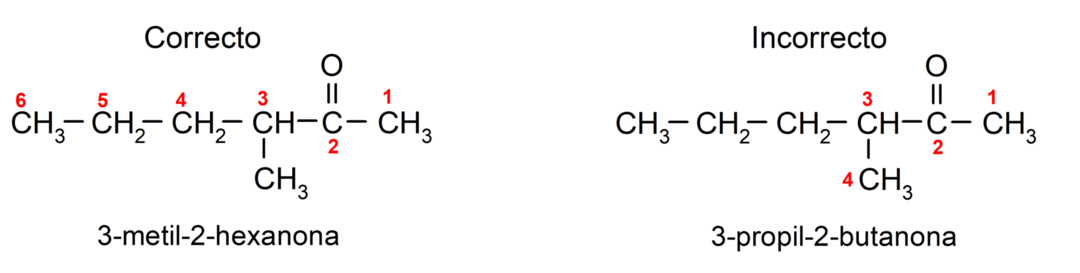
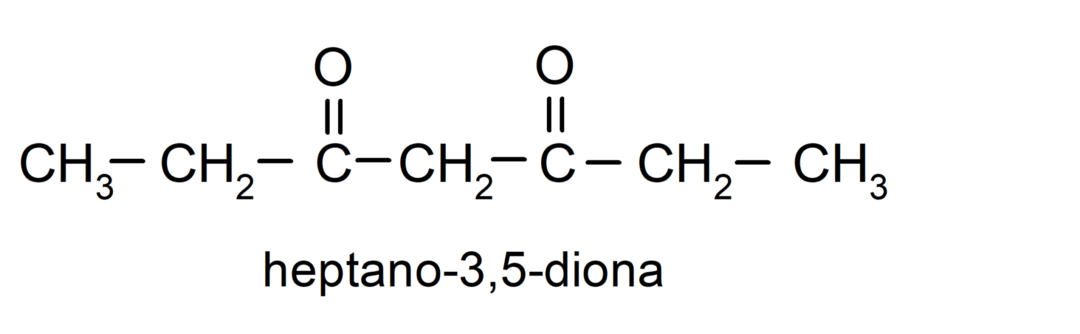
Ir ketoni, kuriem ir divas karbonilgrupas, tos sauc par dioniem. Piemēram:
Aldehīdu piemēri
- metanāls (formaldehīds)
- etanāls (acetaldehīds)
- propanāls (propaldehīds)
- butanāls
- pentanāls
- heksanāls
- 3-bromciklopentānakarbaldehīds
- cikloheksānkarbaldehīds
- benzaldehīds
- 4,4-dimetilpentanāls
- 2-hidroksibutanāls
- 2-hidroksi-2-metil-butanāls
- 2,3-dimetilpentanāls
- pentānforma
- 4-hidroksi-3-metoksibenzaldehīds
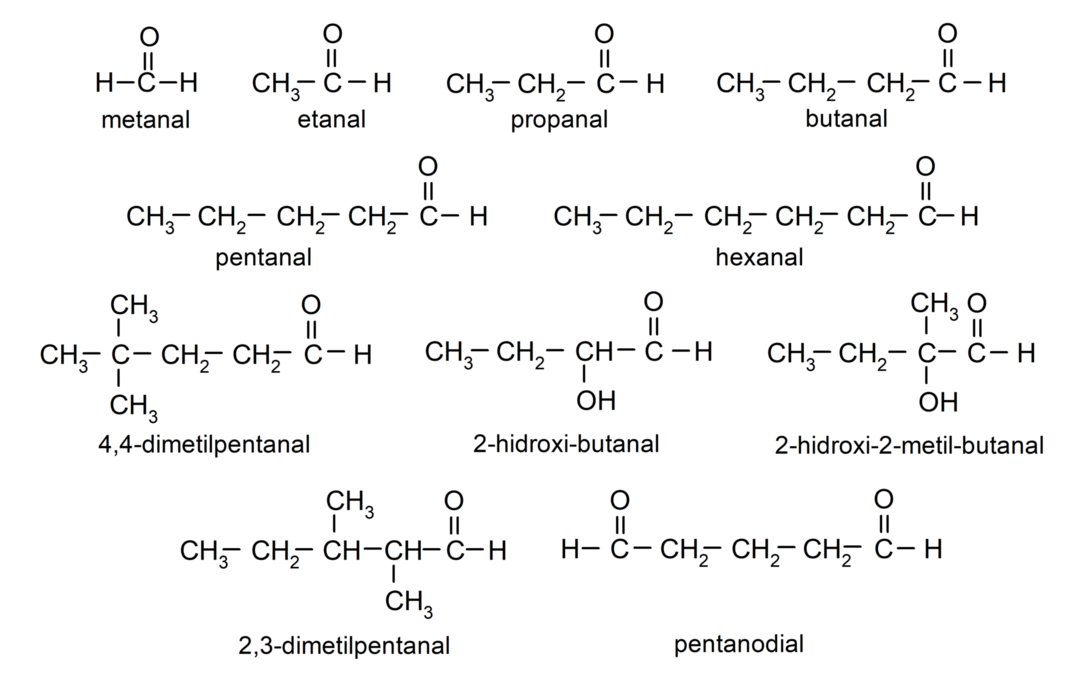
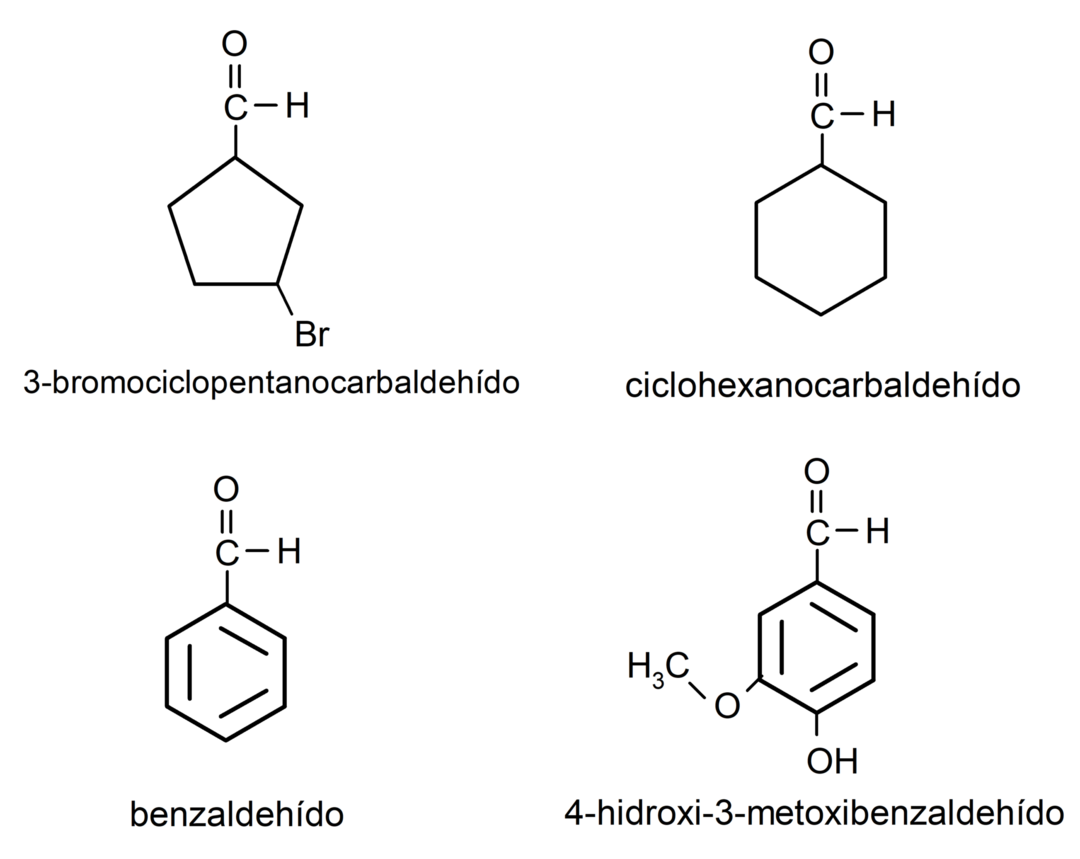
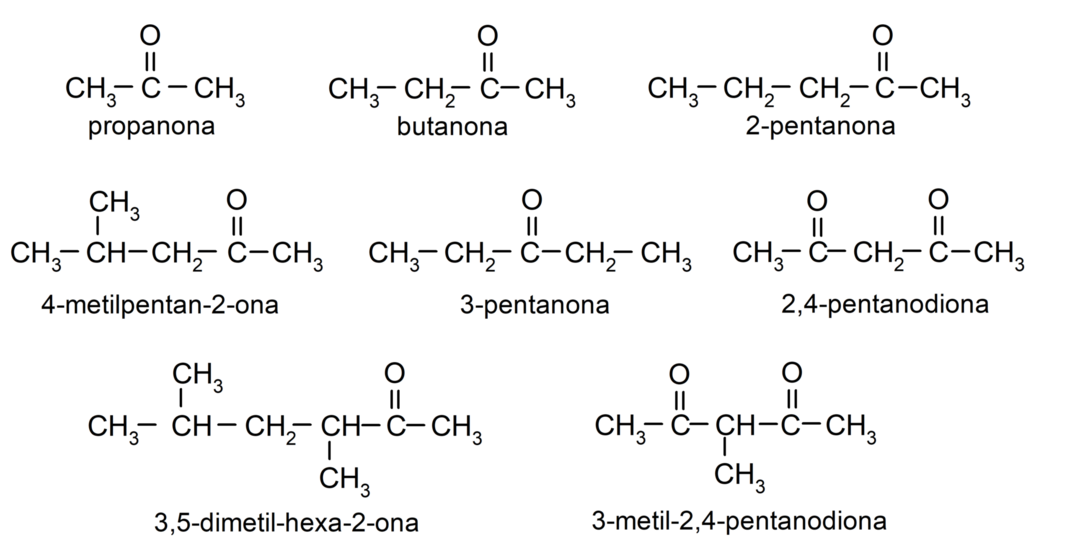
Ketonu piemēri
- propanons (acetons)
- butanons
- 2-pentanons
- 4-metilpentan-2-ons
- 3-metilcikloheksanons
- cikloheksilmetilketons
- 3,4-dimetil-heksān-2-ons
- etilfenilketons
- 2,4-pentāndions
- cikloheksanons
- 3-pentanons
- 3-metil-2,4-pentāndions
- 1-fenilpropanons
- ciklopentanons
- difenilketons
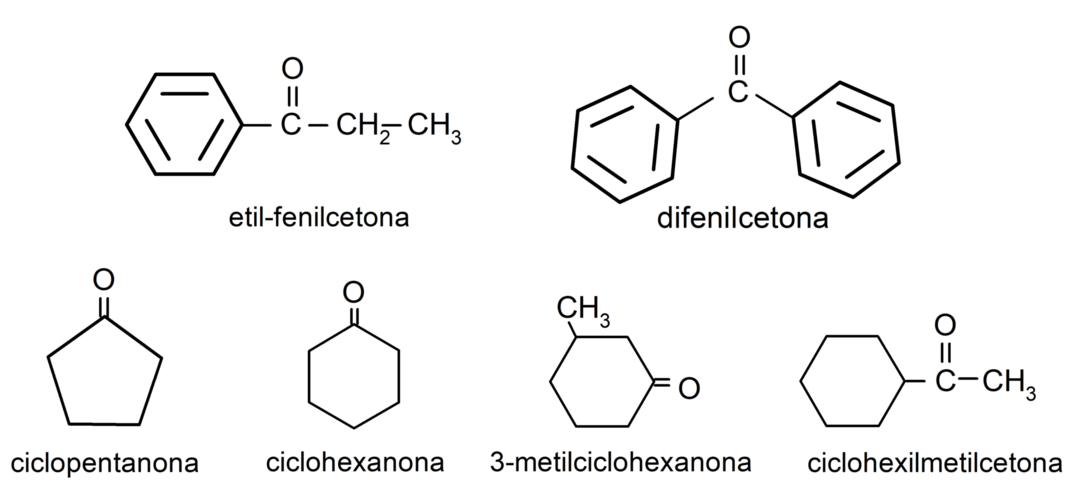
Aldehīdu izmantošana ikdienas dzīvē
Daži aldehīdu lietojumi ir:
- Tos izmanto šķīdinātāju, krāsu, smaržu, sveķu un esenču ražošanai.
- Tos izmanto kā konservantus kosmētikas produktos, bioloģiskajos paraugos un līķos. Šiem nolūkiem visbiežāk izmanto formaldehīdu.
- Tos izmanto plastmasas ražošanai, kas ļauj nomainīt metāla detaļas automobiļu rūpniecībā.
- Tos izmanto kā aromatizētājus dažiem pārtikas produktiem.
- Tos izmanto kā dezinfekcijas līdzekļus.
- Tie ir izmantoti dažu sprāgstvielu, piemēram, pentaeritritola tetranitrāta (TNPE) ražošanai.
Ketonu lietošana ikdienas dzīvē
Daži ketonu lietojumi ir:
- Tos izmanto šķīdinātāju ražošanā. Īpaši acetons tiek plaši izmantots krāsu un laku noņemšanai.
- Tos izmanto dažu gumiju un smērvielu ražošanā.
- Tos izmanto krāsu, laku un laku ražošanai.
- Tos izmanto medikamentu un kosmētikas ražošanā.
Aldehīdu un ketonu toksicitāte
- Aldehīdi. Saskare ar aldehīdiem izraisa ādas, acu un elpceļu kairinājumu. Turklāt aldehīdu iedarbība ir saistīta ar tādām slimībām kā vēzis, kontaktdermatīts un aknu un neirodeģeneratīvas slimības. Piemēram, PVO (Pasaules Veselības organizācija) uzskata formaldehīdu par kancerogēnu savienojumu.
- ketoni. Atkārtota ketonu iedarbība var izraisīt centrālās nervu sistēmas bojājumus. Tas var izraisīt atmiņas zudumu, vājumu, muskuļu sāpes un krampjus. Turklāt, ja āda nonāk saskarē ar ketoniem, rodas sausums un plaisas. Savukārt, ja ketoni tiek ieelpoti, rodas elpceļu kairinājums un klepus.
Atsauces
- Llorens Molina, JA. (2018). “Aldehīdi un ketoni: daži piemēri.” http://hdl.handle.net/
- Gabriels Pinto Kanjons, Manuela Martins Sančess, Hosē Marija Ernandess Ernandess, Marija Terēza Martīna Sančesa (2015)Tollensa reaģents: no aldehīdu identificēšanas līdz to izmantošanai nanotehnoloģijās. Vēsturiskie aspekti un didaktiskie pielietojumi.”Sēj. 111 Nr. 3. Spānijas Karaliskā ķīmijas biedrība.
- Viljams Bauers, jaunākais (2000) «Metakrilskābe un atvasinājumi» Ullmann’s Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441.
- "Tie atklāj jaunu toksicitātes mehānismu kancerogēnu savienojumu grupā, kas iegūti no uztura un vides" (2022) In: www.conicet.gov.ar Pieejams: https://www.conicet.gov.ar/ Skatīts: 2023. gada 20. jūnijā.
Sekojiet līdzi:
- Alkoholi
- Cukuri
- Alkāni

