30 Aldehīdu piemēri
Piemēri / / November 06, 2023
The aldehīdi ir organiskie savienojumi kuras veido oglekļa ķēde, kurai ir pievienota gala karbonilgrupa (= C = O) (atrodas vienā ķēdes galā). molekula), kas savukārt ir saistīts ar ūdeņraža atomu.
Ļoti izplatīti aldehīdi ir metanāls (formaldehīds), etanāls (acetaldehīds) un propanāls (propaldehīds).

Daži no šiem savienojumiem ir sastopami dabā, piemēram, vanilīns vai vanilīns ir dabisks aldehīds, kas ir galvenais vaniļas aromatizētājs.
- Skatīt arī: Aldehīdi un ketoni
Aldehīdu nomenklatūra
Aldehīdus var nosaukt, izmantojot Starptautiskās tīrās un lietišķās ķīmijas savienības (IUPAC) nomenklatūras noteikumus.
Lai nosauktu aldehīdu, tiek izmantoti prefiksi, kas norāda oglekļa atomu skaitu, ko oglekļa ķēde ir pievienojusi karbonilgrupai. Karbonilgrupa vienmēr atrodas vienā oglekļa ķēdes galā, kas nozīmē, ka tai vienmēr būs pirmā pozīcija un nav nepieciešams norādīt tās atrašanās vietu ķēdē. Turklāt aldehīda nosaukuma beigās tiek ievietots sufikss -al. Daži piemēri:
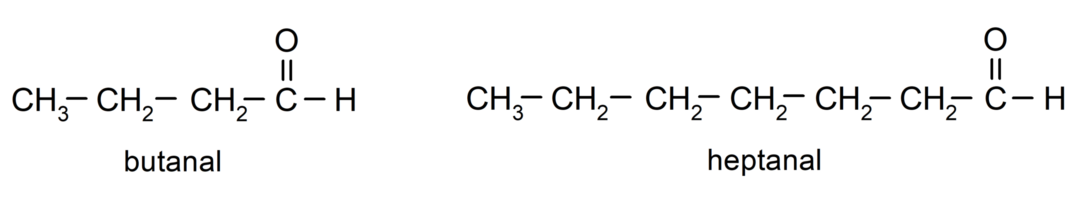
Ja aldehīds ir sazarots, tas ir, tas sastāv no vairākām oglekļa ķēdēm, galvenā ķēde kā ķēde, kurā ir vislielākais oglekļa atomu skaits un kurā ir arī grupa karbonilgrupa. Pārējās ķēdes ir nosauktas kā aizvietotāju grupas.
Turklāt katra aizvietotāju grupa ir jāizvēlas tā, lai tās pozīcija galvenajā oglekļa ķēdē ieņemtu zemāko iespējamo numuru. No otras puses, galvenās ķēdes oglekļa atomus sāk skaitīt beigās, kurā ir karbonilgrupa. Daži piemēri:
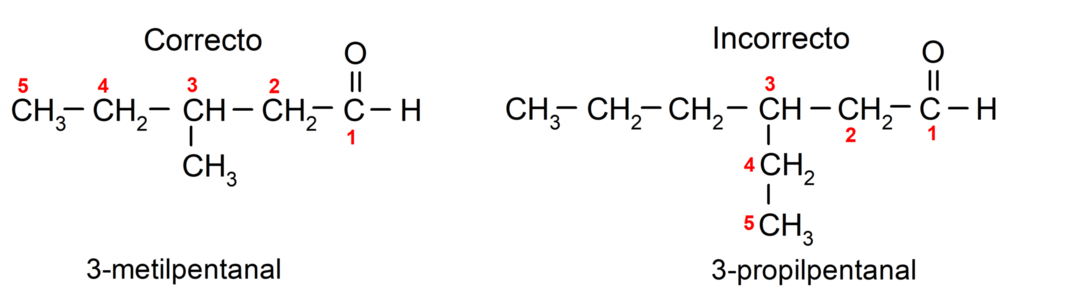
Ja aldehīds darbojas kā aizvietotājs molekulā, jo tas arī sastāv no grupām augstākas prioritātes funkcionālās grupas, piemēram, skābes un esteri, tad aldehīdu grupa tiek nosaukta kā -okso. Piemēram:

Ja aldehīdam ir vairākas karbonilgrupas, to nosauc, izmantojot priedēkļus, kas norāda šo grupu skaitu, dial (divas karbonilgrupas), trial (trīs karbonilgrupas) utt. Piemēram:
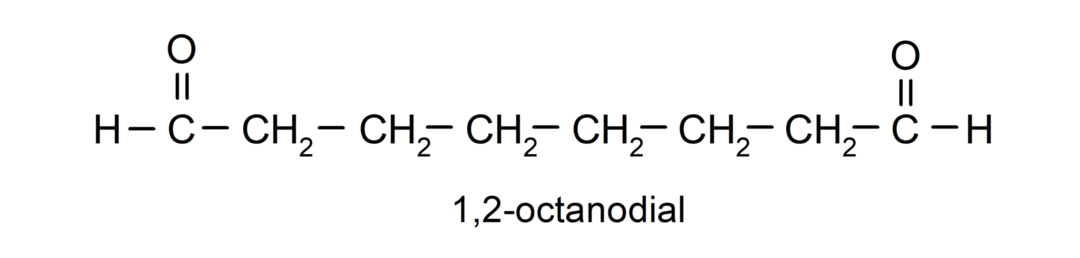
Kad karbonilgrupa ir saistīta ar ciklu, aldehīdus nosauc, izmantojot terminu karbaldehīds. Piemēram:

Aldehīdu fizikālās īpašības
Aldehīdiem parasti ir vienas un tās pašas fizikālās īpašības variācijas. Tas notiek tāpēc, ka aldehīdu fizikālās īpašības ir atkarīgas no tā, kā veidojas oglekļa ķēde, kas pievienota karbonilgrupai.
Dažas aldehīdu fizikālās īpašības ir:
- Šķīdība. Aldehīdu šķīdība ūdenī ir atkarīga no to daudzuma atomi kam ir oglekļa ķēde. Aldehīdi ar īsākām oglekļa ķēdēm (līdz aptuveni pieciem oglekļa atomiem) šķīst ūdenī. Aldehīdi ar daudzu oglekļa atomu oglekļa ķēdēm nešķīst ūdenī. Metanāls un etanāls ļoti labi šķīst ūdenī.
- Blīvums. Kopumā aldehīdi ir savienojumi, kas ir mazāk blīvi nekā ūdens.
- Apkopošanas valstis. Aldehīdi, kas sastāv no viena un diviem oglekļa atomiem, ir gāzes, tie, kas satur trīs līdz divpadsmit oglekļa atomus, ir šķidrumi, un tie, kas sastāv no vairāk nekā divpadsmit oglekļa atomiem, ir cieti.
- Smarža. Dažiem aldehīdiem ir kairinoša smaka, bet citiem ir patīkama smaka.
- Polaritāte. Karbonilgrupa tiem piešķir polaritāti.
- Vārīšanās punkts. Tiem ir augstāka viršanas temperatūra nekā alkāniem ar līdzīgu molekulmasu, un tiem ir zemāka viršanas temperatūra nekā karbonskābēm un spirtiem ar salīdzināmu molekulmasu.
Aldehīdu ķīmiskās īpašības
Dažas no aldehīdu ķīmiskajām īpašībām ir:
Aldehīdi tiek oksidēti, reaģējot ar Tolena, Benedikta un Fēlinga reaģentiem. lai izveidotu atbilstošo karbonskābi. Izveidotajai skābei oglekļa ķēdē būs tikpat daudz oglekļa kā aldehīdam, no kura tā veidojās. Piemēram:
- Oksidēšana ar Tollensa reaģentu (amonija sudraba komplekss bāzes šķīdumā, [Ag (NH)3)2]+). Šī reakcija rada atbilstošo skābi un metālisku sudrabu.

- Oksidēšana ar Benedikta un Fēlinga reaģentu (vara (II) sulfāta (CuSO) sārmaini šķīdumi4) ar dažādiem sastāviem). Šī reakcija rada atbilstošo skābi un vara oksīdu (Cu2ARĪ).

Tajos notiek nukleofīlas pievienošanās reakcijas, kur aldehīdu karbonilgrupai tiek pievienoti nukleofīli. Daži piemēri:
- pievienošanas reakcijas spirti uz aldehīdu karbonilgrupu, veidojot acetālus un pusacetālus.
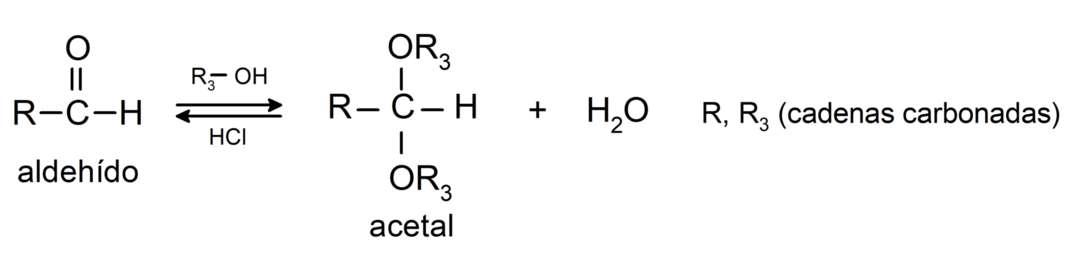
- pievienošanas reakcijas amīni primārais karbonilgrupai.

- Ciānūdeņražskābes (HCN) pievienošanas reakcijas, kurās veidojas ciānhidrīni vai ciānhidrīni.

Tajos notiek aldola kondensācijas reakcijas. Šāda veida reakcijās divi aldehīdi kondensējas, veidojot aldolu. Tās ir reakcijas, kas notiek ar nātrija hidroksīdu (NaOH). Piemēram:
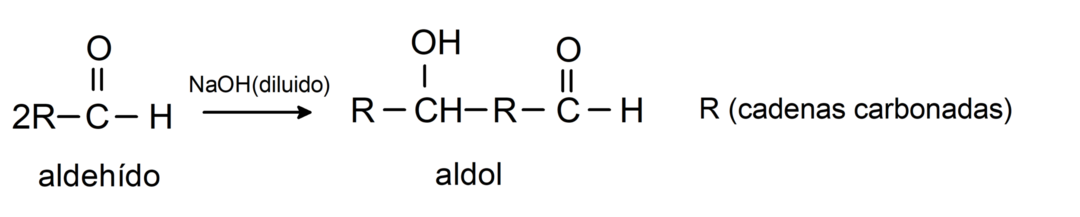
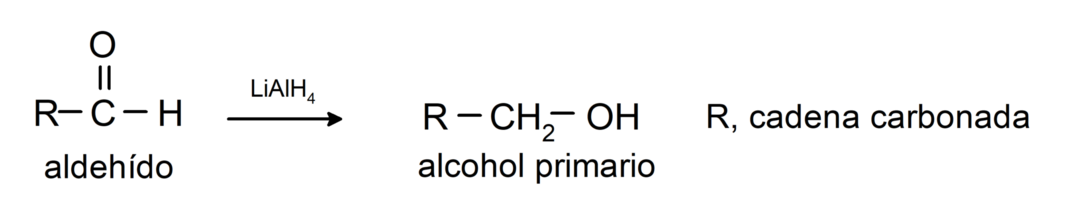
Tie tiek reducēti uz primārajiem spirtiem. Nātrija borhidrīda (NaBH4) un litija alumīnija hidrīda (LiAlH4) klātbūtnē vai ar katalītisku hidrogenēšanu tie tiek reducēti par primārajiem spirtiem. Piemēram:
Aldehīdu piemēri
- metanāls (formaldehīds)
- etanāls (acetaldehīds)
- propanāls (propaldehīds)
- butanāls
- pentanāls
- vanilīns
- kanēļamaldehīds
- propenāls
- benzaldehīds
- heksanāls
- 3-bromciklopentānakarbaldehīds
- cikloheksānkarbaldehīds
- 4,4-dimetilpentanāls
- 2-hidroksibutanāls
- 2-hidroksi-2-metil-butanāls
- 2,3-dimetilpentanāls
- pentānforma
- ciklopentānkarbaldehīds
- izobutāls
- 2-hlorbutanāls

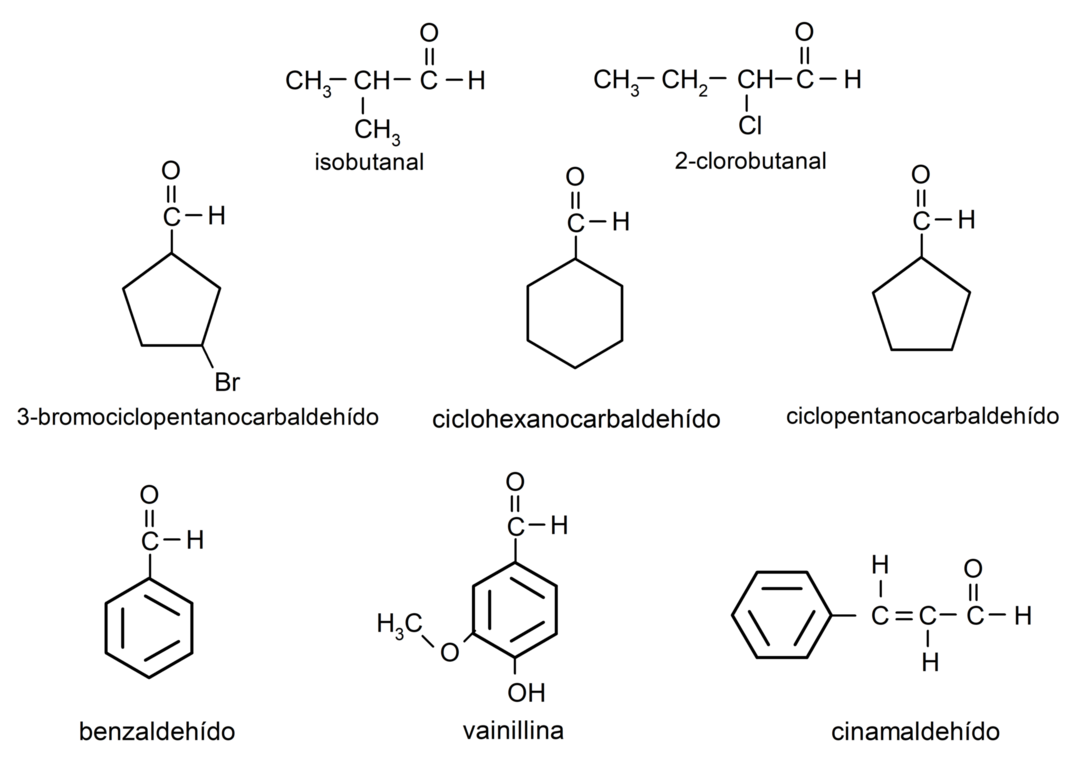
Aldehīdi dabā
Daži dabā esošie aldehīdi ir:
- Benzaldehīds, mandeļu sastāvdaļa.
- Cinnamaldehīds, komponents, kas piešķir kanēļa esencei tās smaržu.
- Vanilīns, komponents, kas piešķir vaniļai garšu.
No otras puses, vienai no glikozes formām, atvērtajai formai, ir aldehīda funkcionālā grupa.
Tiek uzskatīts, ka acetaldehīds, kas veidojas kā starpprodukts alkohola metabolismā, izraisa paģiru simptomus alkohola reibumā.
Aldehīdu izmantošana
Daži no galvenajiem aldehīdu lietojumiem ir:
- Tos izmanto šķīdinātāju, krāsu, kosmētikas līdzekļu un esenču ražošanā.
- Tos izmanto sveķu ražošanā. Bakelīts ir izgatavots no formaldehīda un ir sveķi, kas ļoti labi darbojas kā elektriskais izolators.
- Tie ir izmantoti kā nomierinoši līdzekļi. Paraldehīds ir izmantots kā nomierinošs un miega līdzeklis, lai gan tagad tas vairs netiek izmantots tā nepatīkamās smakas dēļ.
- Tos izmanto kā konservantus bioloģiskajiem paraugiem un līķiem. Formaldehīds tiek plaši izmantots šajā nozīmē.
- Tos izmanto kā pārtikas aromatizētājus. Kā piemēru var minēt vanilīnu, ko izmanto, lai desertiem piešķirtu vaniļas aromātu.
- Tos izmanto kā dezinfekcijas līdzekļus.
Aldehīdu bīstamība
Vairāki aldehīdi ir uzskatīti par kancerogēniem, piemēram, formaldehīds saskaņā ar PVO (Pasaules Veselības organizācija) ir atzīts par kancerogēnu savienojumu.
Daudzu aldehīdu iedarbība un saskare ar tiem izraisa ādas, acu un elpceļu kairinājumu. No otras puses, tas izraisa kontaktdermatītu un aknu slimības.
Atsauces
- Solomons, T.W. Grehems un Marija Kristīna Sangines Frančini (1985). “organiskā ķīmija” Meksika, D.F.: Limusa.
- Vaitens, K. V., Geilijs, K. D., Deiviss, R. E., de Sandovals, M. T. UZ. O. un Murads, R. M. g. (1992). “Vispārējā ķīmija" (lpp. 108-117). Makgreva-Hils.
- Arteaga, P. M. (2017). “Ketoni un aldehīdi” Sagatavošanas skolas zinātniskais biļetens Con-Science Nr. 3, 4(8).
Sekojiet līdzi:
- Cukuri
- Hidracīdi
- Etilspirts
- Organiskie un neorganiskie savienojumi