Tilpuma analīzes piemērs
Ķīmija / / July 04, 2021
Ieslēgts Analītiskā ķīmija, Tilpums ir analīzes metode, kas sastāv no Reaģenta tilpuma mērīšana, kas nepieciešama, lai reaģētu stehiometriski ar analītu, kas ir jānosaka viela.
Reaģējiet stehiometriski attiecas uz vielām, kas mijiedarbojas ķīmiski, saskaņā ar proporcija, kas iezīmē ķīmisko vienādojumu jau līdzsvarots.
Tiek saukta pētāmā viela Analīts. Zināms tilpums tiks ņemts kā šīs vielas paraugs un precīzi izmērīts, ko mēs sauksim Alikvots, kas atrodas Erlenmeijera kolbā, lai sāktu analīzi.
Tilpuma analīzes jēdzieni
Volumetriskā analīze, kas ir Ķīmiskā analīze, nēsāt iesaistīta ķīmiska reakcija. Šī ķīmiskā reakcija tiks veikta starp paraugu ar nezināmu pētāmās vielas daudzumu un zināmu citas vielas daudzumu, kas spēj reaģēt ar iepriekšējo.
The reakcijas vielas būs ūdens šķīdumāun tiks izmērīti šķīdumu tilpumi, kas mijiedarbojās, lai sasniegtu reakcijas beigas, kas būs redzami, pateicoties indikatoram, kas kolbas iekšpusē piešķirs krāsu.
Tilpuma analīzē Zināmo koncentrāciju sauc par standarta risinājumu
, Standarta vai titrantsun kalpos par atsauci reakcijas izbeigšanai, lai veiktu aprēķinu, kas atklās pētāmās vielas daudzumu.Tiek saukta šī procedūra, kā panākt, lai abi risinājumi reaģētu Ķīmiskais grāds o Novērtēšana, kas ir tilpuma analīzes pamatdaļa. Sastāv no došanās pamazām ielejot standarta šķīdumu (Titrants) alikvotā daļā (Paraugs), līdz indikators parāda izmaiņas ar krāsu atšķirību.
A Rādītājs Tā ir ķīmiska viela, ko pievieno alikvotam, parādot krāsojumu, un, kad reakcija beigsies, tā mainīs krāsu.
Tilpuma analīze sastāv no vienkāršas darbību sērijas:
1.- Standarta šķīduma sagatavošana
2.- Parauga vai alikvota sagatavošana
3. - ķīmiskais grāds
4.- Tilpuma mērīšana
5.- Izmeklētās vielas aprēķins.
Līdz vietai, kur viņi to jau ir izdarījuši pilnībā reaģēja abas vielas, to sauc Līdzvērtības punkts.
Tāpat kā jebkurā ķīmiskajā analīzes metodē, arī tilpuma analīzē ir prasības labiem rezultātiem:
-Ķīmiskajai reakcijai jābūt SelektīvsTas ir, standarta šķīdums reaģēs tikai ar paraugu.
-Ķīmiskajai reakcijai jābūt Stehiometriski, tas ir, ievērojiet proporcijas, kas norādītas līdzsvarotajā ķīmiskajā vienādojumā.
-Ķīmiskajai reakcijai jābūt Kvantitatīvs; attiecas uz 99,9% pabeigšanu ekvivalences punktā.
- Jābūt a nosakāms reakcijas beigu punkts, ko labāk apstiprinās rādītājs.
Primārais modelis
The Primārie modeļi Tās ir augstas tīrības pakāpes vielas, kuru koncentrāciju šķīdumā aprēķina tieši no svērtā daudzuma un izlietotā ūdens tilpuma.
A) Jā, var reaģēt ar darba risinājumiem, lai uzzinātu pēdējo koncentrācijas un pārveidotu tās par standarta šķīdumiem.
Primāro modeļu piemēri ir:
-Nātrija karbonāts (Na2CO3): Lieto skābju, piemēram, sērskābes, standartizēšanai.
-Kālija biftalāts: Bāzes standartšķīdumu, piemēram, nātrija hidroksīda, sagatavošana ir galvenais standarts.
-Nātrija hlorīds (NaCl): to izmanto, lai standartizētu sudraba nitrāta šķīdumus.
-Kalcija karbonāts (CaCO3): EDTA (etilēna dimīna tetraetiķskābes) primārais standarts.
Primārajam paraugam jāatbilst vairākām būtiskām īpašībām:
Jābūt Augsta tīrība, Atmosfēras stabilitāte, Hidratācijas ūdens neesamība, Lētas un viegli iegūstamas, Y Augsts ekvivalents svars.
Tilpuma analīzes klasifikācija
Atkarībā no ķīmiskajām sugām, ar kurām jūs strādājat, lai veiktu analīzi, tas būs tilpuma veids:
Skābju bāzes tilpums: Tas darbojas vai nu ar skābi, vai ar bāzi, lai analizētu paraugus, kas satur skābes vai bāzes.
Nokrišņu tilpums: To sauc arī par argentometriju, lai noteiktu, cik daudz hlorīdu ir paraugā, tas izmanto sudraba nitrāta standartšķīdumu.
Sarežģītības tilpums: Cietuma, tas ir, kalcija un magnija karbonātu koncentrācijas mērīšanai ūdenī, tiek izmantots komplekss, piemēram, EDTA, standarta šķīdums.
REDOX tilpums: Reakcija notiek starp oksidējošu un reducējošu vielu.
Rādītāji
No daudzajiem Volumetrics izmantotajiem rādītājiem izceļas trīs:
1.- Metiloranžs: Alikvotā daļai ir jābūt oranžai krāsai, kas tiks titrēta ar skābi. Sasniedzot ekvivalences punktu, indikators kļūs dzeltens.
2.- Fenolftaleīns: Sākotnēji tas ir caurspīdīgs alikvotā daļā, kuras nosaukums būs pamats. Sasniedzot ekvivalences punktu, indikators kļūs sārts.
3.- Eriohroms melns: Tas ir indikators, ko izmanto, lai noteiktu cietību ūdenī. Sākumā alikvotā daļa ir purpursarkana, līdz to titrē ar kompleksu veidojošu līdzekli. Reakcijas beigās tas kļūst zils.

Instrumenti tilpuma analīzē
Volumetriskajā analīzē tiks izmantota virkne instrumentu, kurus, ja tie nav pieejami, nevar atbilstoši izstrādāt:
1.- tilpuma kolba: tā ir tvertne kā spuldze tās apakšējā daļā, apakšā saplacināta, kurai ir plāna kolonna, kurā pievieno šķidrumu. Tam ir atzīme, kas norāda šķidruma meniska vietu, lai tā aptvertu precīzu tilpumu. To izmanto, lai saturētu standarta risinājumus; pateicoties tā tilpuma precizitātei, tiek nodrošināta zināma koncentrācija.

2.- Pipetes: tās ir plānās mēģenēs, kas ļauj droši izmērīt precīzu šķidruma daudzumu. Tie ir pieejami līdz 25 mililitriem un ļauj precīzi ņemt paraugus.
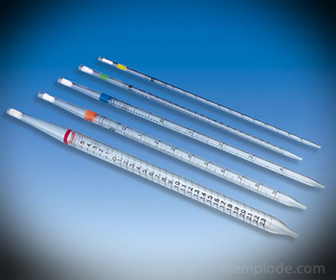
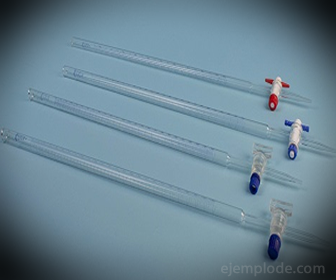
3. - birete: tā ir iegarena caurule ar tilpumu 50 mililitri, kurā būs standarta šķīdums. Vienā no tā galiem ir plūsmas regulēšanas vārsts, kas novadīs šķīdumu alikvotā.
4. - Erlenmeijera kolbas: tie ir trauki ar plakanu pamatu, koniskas formas, kas beidzas ar cilindrisku malu. Šis dizains padara tos piemērotus ķīmiskām titrēšanai, jo tie neļauj šķīdumu kratīšanu tos pārplūst. Lai veiktu atkārtotu testēšanu, būs nepieciešami vismaz trīs, lai nodrošinātu ticamu rezultātu.

Aprēķini tilpuma analīzē
Apstrādājot ūdens šķīdumus, tilpuma analīzei nozīmīgi lielumi ir Koncentrācija un Tilpums.
Galvenais tilpuma vienādojums ir balstīts uz četriem galvenajiem datiem:
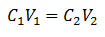
C1= Parauga koncentrācija (nezināma)
V1= Alikvotas tilpums, ar kuru tika veikta analīze
C2= Standartšķīduma koncentrācija, ko izmanto, lai sasniegtu ekvivalences punktu
V2= Tilpuma standarta šķīdums, kas nepieciešams reakcijas beigām
Dati tiek aizstāti vienādojumā, atstājot nezināmu tikai meklēto koncentrāciju. Protams, visiem datiem jābūt vienādos diskos.
Tilpuma analīzes piemēri
Hlorīdu (Cl-) noteikšana ar argentometriju ar sudraba nitrātu.
Bromīdu (Br-) noteikšana ar argentometriju ar sudraba nitrātu.
Cianīdu (CN-) noteikšana ar argentometriju ar sudraba nitrātu.
Magnija karbonāta (MgCO) noteikšana3), izmantojot kompleksometriju, ar EDTA.
Kalcija karbonāta (CaCO2) noteikšana3), izmantojot kompleksometriju, ar EDTA.
Sērskābes analīze (H2DR4) ar nātrija hidroksīdu (NaOH).
Nātrija hidroksīda (NaOH) un sālsskābes (HCl) analīze.
Antimona (III) noteikšana ar kālija permanganātu (KMnO4).
Arsēna (III) noteikšana ar kālija permanganātu (KMnO4).
Titāna (III) noteikšana ar kālija permanganātu (KMnO4).
Molibdēna (III) noteikšana ar kālija permanganātu (KMnO4).
Dzelzs (II) noteikšana ar kālija permanganātu (KMnO4).
Oksalāta jona noteikšana ar kālija permanganātu (KMnO4).

