Reaktīvo materiālu piemērs
Ķīmija / / July 04, 2021
The Reaktīvie materiāli ir tās vielas, kuras, nonākot saskarē ar kādu citu, mēdz sākt ķīmisku reakciju. Šīs reakcijas beigās rodas noteikts daudzums dažādu vielu.
Reaģētspēja vielās
The Reaktivitāte ir vielu spēja mijiedarboties ar citiem ķīmiskā reakcijā. Visus šīs reakcijas dalībniekus sauks par reaktīviem. Kad ķīmiskā parādība beidzas, sauc dažādas vielas Produkti.
Rūpnieciskajā vidē reaktivitāte tiek izmantota, kad vēlaties ģenerēt produkta daudzumu gribēja. Rūpniecības uzņēmumos tiek izvēlēts izejmateriāls, kura sastāvā ir atbilstoši reaģenti, to ievieto tvertnē ar nosaukumu Reaktors, lai ķīmiskā reakcija noritētu, un pārliecinieties, vai ir ekonomisks process un efektīvs.
Ir reizes, kad reakcija tas būs spontāni, un tas tiks veikts bez piepūles, tikai saskaroties ar reaģentiem. Būtu tikai jāsakrata reaģenti, lai veicinātu to iekļaušanu.
Citos gadījumos ar vienkāršu reaģentu kontaktu nepietiks, bet būs jāmaina nosacījumi vai nu pievienojot vairāk reakcijas reakcijai, vai arī ieviešot karsēšanu vai pat atdzesēšanu, lai reakcija sāktos un noritētu ar lielāku ātrumu un ražu.
Reaģenti sāks iesaistīties Produktu ģenerēšanā, bet viņi to darīs pēc proporcijas tas norāda vienādojumu, kas izsaka reakciju, kā norādīts šādi:
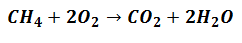
Tas nozīmē, ka metāna reaģenti (CH4) un skābekli (O2) tiks sajaukti proporcijā no 1 līdz 2 molekulārajām vienībām lai izveidotu atbilstošos produktus.
Ja kāds no reaģentiem ir pievienots vismazākā summa kas ir nepieciešams pēc aprēķina, tiks izsaukts Reaģenta ierobežošana, jo, kad viss tiks iztērēts, reakcija apstāsies.
Tiks izsaukts otrs reaģents, kas reakcijas beigās būs pārpalikums Reaktīvs pārpalikumā, un, protams, tas nāks kopā ar Produktiem.
Vielu reaktivitāti var izmantot daudzām ķīmiskām parādībām, piemēram, Oksidācijas, kālija permanganāta gadījumā; Katalīze, tāpat kā platīna metāla gadījumā ar smalku sietu; elementu apmaiņa, tāpat kā metāla cinka gadījumā, kas skābēs aizvieto ūdeņradi.
Reaktivitāte kā bīstamu materiālu īpašība
The Reaktivitāte pārstāv a riskants īpašums kad reaktīvais materiāls jau ir atkritums bez lietošanas, tāpēc to vispirms ielej traukā, kas nodrošina tā izolāciju no cilvēka saskares. Ja atkritumi ir cieti vai šķidri, tie parasti ir biezos plastmasas traukos, uz kuriem obligāti ir uzlīme ar "Reaģenta materiāla" piktogramma, kas ir attēls ar oranžu fonu un atbilstošo simboloģiju melnā krāsā. Šis attēls parāda signālu dažādību dažādiem reaktivitātes veidiem.

Reaktivitāte ir viena no īpašībām Bīstamo atkritumu CRETIB: Kodīgs, reaktīvs, sprādzienbīstams, toksisks, viegli uzliesmojošs un bioloģiski infekciozs. Faktiski tas ir visreprezentatīvākais, jo visas pārējās īpašības ir saistītas ar reaktivitātes režīmu.
Ļoti bieži šo materiālu bīstamība ir pakļauta šo vielu noplūdei. Piemēram, kad rodas sērskābes noplūde un tā izplūst ļoti lielā platībā, personāls, kuram nav apmācības situācijas kontrolei, ir jānovērš. Cilvēkiem, kas ir apmācīti, ir jāiejaucas.
Bīstamās situācijas novēršanas procedūra sākas, dodoties uz vietu, valkājot atbilstošos individuālos aizsardzības līdzekļus. Identificējiet un izolējiet reaktīvā materiāla noplūdes zonu un sāksit neitralizēt tā reaktivitāti ar citu ķīmiski pretēju sugu. Šajā gadījumā sērskābe darbojas kā skābe. Šo reaktivitāti būs iespējams nodzēst tikai ar tādu sugu kā nātrija hidroksīds, kas ir viena no spēcīgākajām bāzēm.
Reakciju starp skābi un bāzi sauc par neitralizāciju. Ar šīs parādības palīdzību sērskābes reaktivitāte noplūdē tiks virzīta uz nātrija hidroksīda aktivitāti.
Pienāks laiks, kad nātrija hidroksīds, arī reaktīvs materiāls, izbeigs sērskābes bīstamību. Kad reakcija būs beigusies, būs tikai jāatšķaida produkti ar bagātīgu ūdens plūsmu.

Reaktīvo materiālu piemēri
- Nātrija hidroksīds
- Kalcija hidroksīds
- Magnija hidroksīds
- Sērskābe
- Sālsskābe
- Slāpekļskābe
- Ūdeņraža sulfīds
- Kālija nitrāts
- Nātrija bikarbonāts
- Oglekļa dioksīds
- Sēra dioksīds
- Sēra trioksīds
- Ūdeņraža gāze
- Gāzveida skābeklis
- Hlora gāze
- Gāzveida broms
- Metālisks litijs
- Metālisks nātrijs
- Metālisks cēzijs
- Metālisks magnijs
- Amonija nitrāts
- Nātrija hlorīds
- Kālija hlorīds
- Kalcija hlorīds
- Kālija permanganāts
- Nātrija permanganāts
- Metālisks platīns
- Metāla cinks
- Kalcija karbīds
- Acetilēns
- Metāns
- Etāns
- Propāns
- Butāns
