10 voorbeelden van gasmengsels
Diversen / / July 04, 2021
mengsels van gasvormige stoffen Ze zijn enkele van de gemakkelijkst te bereiken, omdat het heel goed mogelijk is dat stoffen die zich in deze staat van aggregatie bevinden, worden gemengd. Bijvoorbeeld: Neon, argon en xenon mengsel, spuitbus insecticide, lucht en helium.
Vrijwel alle gassen zijn onbeperkt combineerbaar, uiteraard geconditioneerd door sommigen chemisch, fysisch en fundamenteel gerelateerd aan veiligheidsaspecten voor de gebruiker die: manipuleert. Net als de verschillende soorten mengsels die tussen stoffen tot stand komen, zijn mengsels van gassen ze hebben ook eigenschappen die uniek zijn voor hen.
De studie van koolzuurhoudende mixen is meestal net zo nuttig als die van gassen in hun zuivere staat: dezelfde kennis over de lucht die aanwezig is in de atmosfeer zou onmogelijk zijn zonder de kennis over de verhoudingen en het gedrag van menggassen.
Op deze manier is het essentieel om wat te weten Kenmerken van gasmengsels, zoals de eigenschap van partiële druk (die wordt uitgeoefend door elk van de gassen in de mengsel) en die van de molaire fractie (verhouding tussen het aantal mol van een gasvormige component en dat van het totale mengsel Frisdrank). De mol geeft de hoeveelheid gas in het mengsel weer.
De Wet van Daltonton stelt dat de totale druk van een gasmengsel gelijk is aan de som van de partiële drukken van elk een van de individuele gassen die eraan deelnemen (dit is afhankelijk van de gassen die niet reageren tussen) Ja). De partiële druk wordt hier begrepen als de druk die elk van de gassen zou uitoefenen als het alleen in dezelfde container en onder dezelfde omstandigheden van temperatuur-. A) Ja:
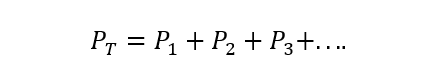
Waar PT is de totale druk en P1, P2 En P3 zijn de partiële drukken van de hypothetische gassen 1, 2 en 3 in het gasmengsel.
Met behulp van de wet van Dalton is een uitdrukking ontwikkeld om de te berekenen gedeeltelijke druk van een gas in een gasvormig mengsel als we de totale druk en de molfractie kennen.
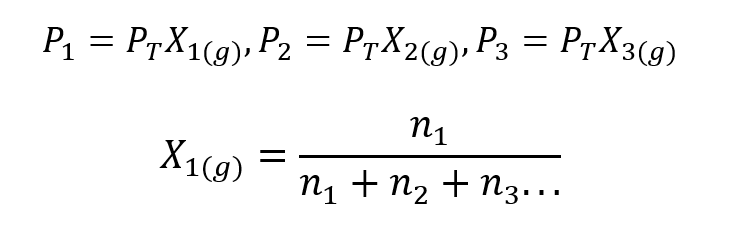
Waar X1, X2 Y X3 zijn de molfracties van de hypothetische gassen 1, 2 en 3 in het gasmengsel, en nee1, nee2 Y nee3 zijn de hoeveelheden stof van elk van deze gassen in hetzelfde mengsel.
Een van de belangrijkste eigenschappen van de componenten in mengsels is de concentratie, die in verschillende eenheden kan worden uitgedrukt. In het geval van gasmengsels kan de concentratie van de componenten worden uitgedrukt in ppm (parts per million), een eenheid die betrekking heeft op het volume. Dat wil zeggen, een bepaalde hoeveelheid ppm van een component in een gasmengsel is de verhouding van het volume van die bepaalde hoeveelheid tot het volume van elke miljoen eenheden mengsel.
Het is belangrijk om in acht te nemen dat ppm van een gas zijn afhankelijk van de temperatuur en druk van het gas. Om deze reden worden voor het berekenen van de ppm van een gas gewoonlijk normale druk- en temperatuuromstandigheden gebruikt. (CNPT), die een normale toestand geven aan een temperatuur van 0 graden Celsius en 1013 hectopascal (1 bar) van Druk. Als deze voorwaarden niet worden gebruikt, moet u aangeven welke wel worden gebruikt.
Het kan u van dienst zijn:
Voorbeelden van gasmengsels
De volgende lijst bevat gasmengsels, met vermelding van de elementen die in het mengsel voorkomen:
- Lucht (mengsel van 21% zuurstof en 79% stikstof, plus andere gassen in kleine hoeveelheden)
- Cronigón (mengsel van 99% argon en 1% zuurstof)
- Trimix (mengsel van zuurstof, stikstof en helium)
- Neon, argon en xenon mix
- Mix van 85% methaan, 9% ethaan, 4% propaan en 2% butaan.
- Zwavelhexafluoride en lucht
- aërosol insecticide
- Lucht en helium
- Nitrox (luchtmengsel, verrijkt met zuurstof en stikstof)
Volgen met: