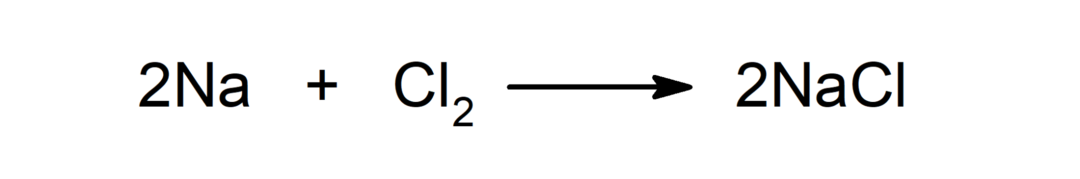20 voorbeelden van ionen
Diversen / / July 04, 2021
Wanneer een atoom of molecuul verlies je elektrische neutraliteit toevallig de denominatie ontvangt van ion. Het proces dat gepaard gaat met de winst of het verlies van een of meer elektronen dat de atomaire structuur van een neutraal atoom of een neutrale verbinding kenmerkt, wordt ionisatie genoemd. De meest elementaire kennis van ionenvorming wordt toegeschreven aan de Engelse chemicus Humphrey Davy (1778-1829) en zijn leerling, Michel Faraday (1791-1867). Bijvoorbeeld: chloride-anionen, calciumkation, sulfide-anion;.
Wanneer een elektrisch neutraal atoom een of meer elektronen krijgt, wordt een anion gevormd. De anionen worden aangetrokken door de anode, een elektrode waarin een stof elektronen verliest, dat wil zeggen, het oxideert, en dit gebeurt door een reactie van oxidatie.
Aan de andere kant, wanneer een elektrisch neutraal atoom een of meer elektronen verliest, a kation. De kationen worden aangetrokken door de kathode, een elektrode waarin een stof elektronen opneemt, dat wil zeggen, deze wordt gereduceerd, en dit gebeurt door een reductiereactie. De elektronen die verloren gaan zijn die van het laatste energieniveau van het neutrale atoom.
In de anionenElk elektron in het atoom, dat oorspronkelijk neutraal is, wordt sterk vastgehouden door de positieve lading van de kern. In tegenstelling tot de rest van de andere elektronen in het atoom, is in anionen het extra elektron echter niet verbonden met de kern door Coulomb-krachten, (elektrische interactiekrachten van twee puntladingen die in rust zijn en recht evenredig zijn met de vermenigvuldiging van de grootte van de twee ladingen en omgekeerd evenredig met het kwadraat van de afstand die beide scheidt ladingen).
Dus in anionen is het extra elektron gebonden door de polarisatie van het neutrale atoom. Door de toevoeging van elektronen overtreffen de anionen het corresponderende neutrale atoom, terwijl de De grootte van de kationen is kleiner dan die van de corresponderende neutrale atomen, door het verlies van elektronen.
Bij kamertemperatuur, veel teken ionen daartegenover binden ze sterk aan elkaar volgens een regelmatig en geordend schema dat aanleiding geeft tot de vorming van kristallen, zoals keukenzout (natriumchloride). vaak wanneer? jij gaat uit oplossen in een oplosmiddel, ze ioniseren gemakkelijk.
Omdat ze zijn opgelost, vormen ionen de basis van belangrijke industriële processen zoals elektrolyse en leggen de basis voor essentiële apparaten van de moderne wereld, zoals batterijen en accu's. In de processen van enzymatische oxidaties en reducties, zo kenmerkend in ontelbare biochemische reacties die plaatsvinden in levende wezens, verschillende ionen nemen deel.
De elementen die normaal gesproken het grootste vermogen hebben om positief te ioniseren (om elektronen te verliezen en dus kationen te genereren) zijn de metalen. Bepaalde niet-metalen vormen in het algemeen anionen en Edelgassen net als helium of argon vormen ze geen ionen.
Over het algemeen zijn ionen chemisch reactiever dan neutrale atomen en moleculen en kunnen ze monoatomisch of polyatomisch, anorganisch of organisch zijn.
Voorbeelden van ionen
Hieronder staan 20 voorbeelden van ionen, waaronder anionen, kationen, mono-atomaire en polyatomaire ionen.
- Chloride-anionen (Cl–)
- Sulfaatanionen (SO42-)
- Nitraatanionen (NO3–)
- Calciumkation (Ca2+)
- Mangaan (II) kation (Mn2+)
- Hypochloriet anion (ClO–)
- Ammoniumkation (NH4+)
- IJzerkation (Fe3+)
- Ferro kation (Fe2+)
- Magnesium kation (Mg2+)
- Silicaatanionen ([SiO4]4- )
- Boraatanionen ([BO3]3- )
- Permanganaatanion (MnO4–)
- Sulfide-anion (S2-)
- Fosfaatanion (PO43-)
- Metafosfaat anion (PO3–)
- Carbonaat anionen (CO32-)
- Citraatanion ([C3H5O (COO)3]3- )
- Malaat anion ([C4H4OF5]2-)
- Acetaatanion ([C2H3OF2]– )