30 Voorbeelden van aldehyden
Voorbeelden / / November 06, 2023
De aldehyden Zijn organische bestanddelen die worden gevormd door een koolstofketen waaraan een terminale carbonylgroep (= C = O) is bevestigd (bevindt zich aan het ene uiteinde van de molecuul), dat op zijn beurt gebonden is aan een waterstofatoom.
Veel voorkomende aldehyden zijn methanal (formaldehyde), ethanal (aceetaldehyde) en propanal (propaldehyde).

Sommige van deze verbindingen zijn in de natuur aanwezig, bijvoorbeeld vanilline of vanilline is een natuurlijk aldehyde dat de belangrijkste smaakstof van vanille vormt.
- Zie ook: Aldehyden en ketonen
Nomenclatuur van aldehyden
Aldehyden kunnen worden benoemd met behulp van de nomenclatuurregels die zijn opgesteld door de International Union of Pure and Applied Chemistry (IUPAC).
Om een aldehyde een naam te geven, worden voorvoegsels gebruikt die het aantal koolstofatomen aangeven dat de koolstofketen aan de carbonylgroep heeft vastgemaakt. De carbonylgroep bevindt zich altijd aan het ene uiteinde van de koolstofketen, wat betekent dat deze altijd positie één zal hebben en dat het niet nodig is om de locatie ervan in de keten aan te geven. Bovendien wordt het achtervoegsel -al aan het einde van de aldehydenaam geplaatst. Enkele voorbeelden zijn:
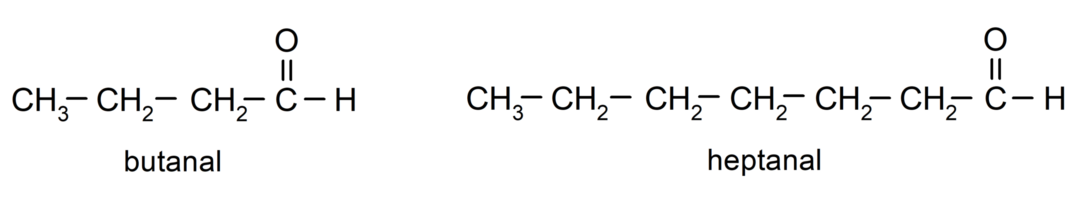
Als het aldehyde vertakt is, dat wil zeggen, het bestaat uit verschillende koolstofketens, de hoofdketen als de keten die het grootste aantal koolstofatomen heeft en die ook de groep bevat carbonyl. De rest van de ketens worden genoemd als substituentgroepen.
Bovendien moet elke substituentgroep zo worden gekozen dat zijn positie de laagst mogelijke nummering in de hoofdkoolstofketen inneemt. Aan de andere kant beginnen de koolstofatomen van de hoofdketen te worden geteld aan het uiteinde dat de carbonylgroep bevat. Enkele voorbeelden zijn:
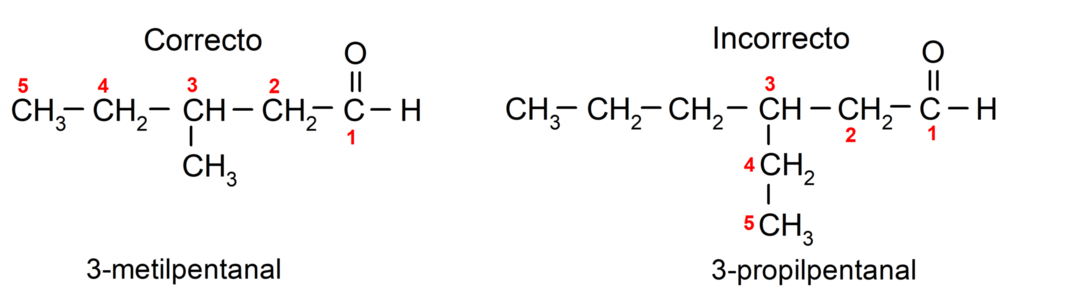
Als het aldehyde als substituent in het molecuul fungeert, omdat het ook uit groepen bestaat functionele stoffen met een hogere prioriteit, zoals zuren en esters, dan wordt de aldehydegroep genoemd -oxo. Bijvoorbeeld:

Als een aldehyde meerdere carbonylgroepen heeft, wordt het benoemd met voorvoegsels die het aantal van deze groepen aangeven, wijzerplaat (twee carbonylgroepen), proef (drie carbonylgroepen), enz. Bijvoorbeeld:
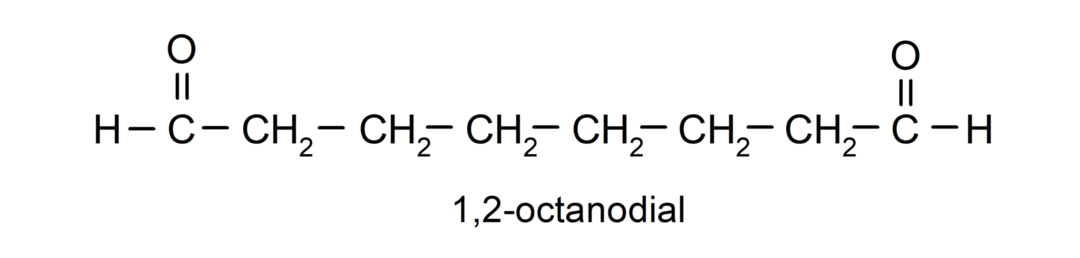
Wanneer de carbonylgroep aan een cyclus is gekoppeld, worden aldehyden genoemd met de term carbaldehyde. Bijvoorbeeld:

Fysische eigenschappen van aldehyden
Aldehyden hebben gewoonlijk enige variatie van dezelfde fysieke eigenschap. Dit gebeurt omdat de fysische eigenschappen van aldehyden afhangen van hoe de koolstofketen die aan de carbonylgroep is bevestigd, wordt gevormd.
Enkele fysische eigenschappen van aldehyden zijn:
- Oplosbaarheid. De wateroplosbaarheid van aldehyden hangt af van de hoeveelheid atomen dat de koolstofketen heeft. Aldehyden met kortere koolstofketens (tot ongeveer vijf koolstofatomen) zijn oplosbaar in water. Aldehyden met koolstofketens van veel koolstofatomen zijn niet oplosbaar in water. Methanal en ethanal zijn zeer oplosbaar in water.
- Dikte. Over het algemeen zijn aldehyden verbindingen die een lagere dichtheid hebben dan water.
- Aggregatie Staten. Aldehyden bestaande uit één en twee koolstofatomen zijn dat wel gassen, die met tussen de drie en twaalf koolstofatomen zijn dat wel vloeistoffen, en die bestaande uit meer dan twaalf koolstofatomen zijn vast.
- Geur. Sommige aldehyden hebben een irriterende geur, terwijl andere een aangename geur hebben.
- Polariteit. De carbonylgroep geeft ze polariteit.
- Kookpunt. Ze hebben hogere kookpunten dan alkanen met een vergelijkbaar molecuulgewicht, en ze hebben lagere kookpunten dan carbonzuren en alcoholen met een vergelijkbaar molecuulgewicht.
Chemische eigenschappen van aldehyden
Enkele van de chemische eigenschappen van aldehyden zijn:
Aldehyden worden geoxideerd wanneer ze reageren met Tollens-, Benedict- en Fehling-reagentia. om het overeenkomstige carbonzuur te vormen. Het gevormde zuur zal hetzelfde aantal koolstofatomen in de koolstofketen hebben als het aldehyde waaruit het is gevormd. Bijvoorbeeld:
- Oxidatie met Tollens-reagens (ammoniakzilvercomplex in basische oplossing, [Ag (NH3)2]+). Deze reactie produceert het overeenkomstige zuur en metallisch zilver.

- Oxidatie met Benedict- en Fehling-reagens (alkalische oplossingen van koper (II) sulfaat (CuSO4) met verschillende composities). Deze reactie produceert het overeenkomstige zuur en koperoxide (Cu2OF).

Ze ondergaan nucleofiele additiereacties, waarbij nucleofielen worden toegevoegd aan de carbonylgroep van aldehyden. Enkele voorbeelden zijn:
- toevoeging reacties alcoholen aan de carbonylgroep van aldehyden om acetalen en hemiacetalen te vormen.
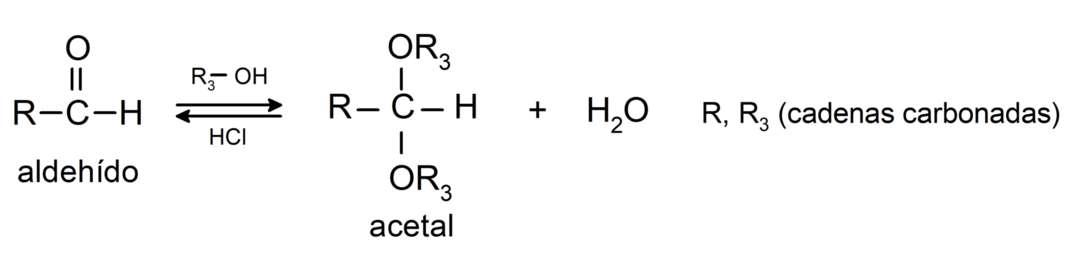
- toevoeging reacties aminen primair ten opzichte van de carbonylgroep.

- Blauwzuur (HCN)-additiereacties, waarbij cyaanhydrinen of cyaanhydrinen worden gevormd.

Ze ondergaan aldolcondensatiereacties. Bij dit type reactie condenseren twee aldehyden om een aldol te vormen. Het zijn reacties die optreden met natriumhydroxide (NaOH). Bijvoorbeeld:
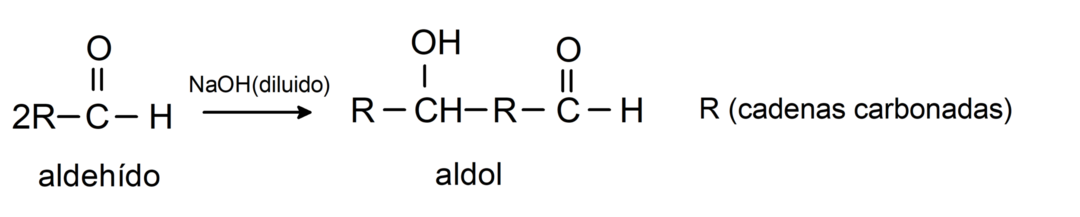
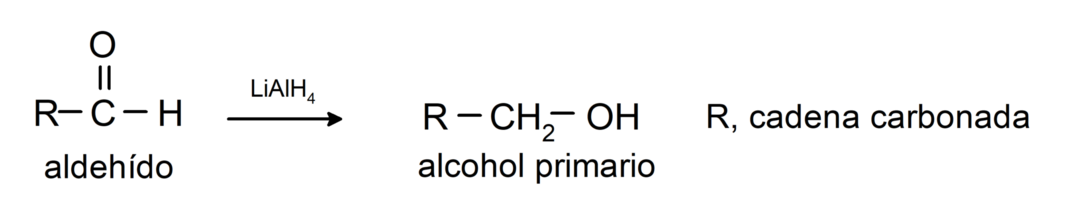
Ze ondergaan reductiereacties op primaire alcoholen. In aanwezigheid van natriumboorhydride (NaBH4) en lithiumaluminiumhydride (LiAlH4) of door katalytische hydrogenering worden ze gereduceerd tot primaire alcoholen. Bijvoorbeeld:
Voorbeelden van aldehyden
- methanaal (formaldehyde)
- ethanal (aceetaldehyde)
- propanal (propaldehyde)
- butanaal
- pentanaal
- vanilline
- kaneelaldehyde
- propenaal
- benzaldehyde
- hexanaal
- 3-broomcyclopentaancarbaldehyde
- cyclohexaancarbaldehyde
- 4,4-dimethylpentanal
- 2-hydroxybutanal
- 2-hydroxy-2-methylbutanal
- 2,3-dimethylpentanal
- vijfhoekig
- cyclopentaancarbaldehyde
- isobutaal
- 2-chloorbutanal

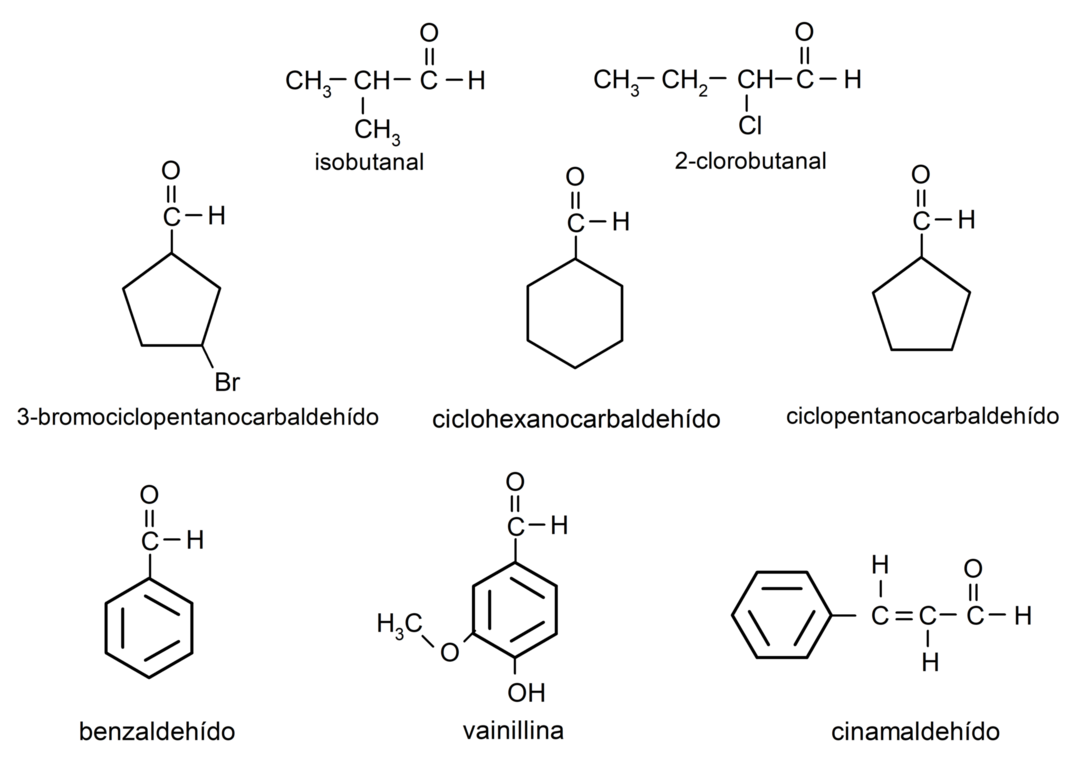
Aldehyden in de natuur
Sommige aldehyden die in de natuur voorkomen zijn:
- Benzaldehyde, een bestanddeel van amandelen.
- Kaneelaldehyde, het bestanddeel dat de kaneelessence zijn geur geeft.
- Vanilline, het bestanddeel dat vanille zijn smaak geeft.
Aan de andere kant heeft een van de vormen van glucose, de open vorm, een functionele aldehydegroep.
Aangenomen wordt dat acetaldehyde, dat wordt gevormd als tussenproduct bij de metabolisatie van alcohol, katersymptomen veroorzaakt wanneer het wordt bedwelmd door alcohol.
Gebruik van aldehyden
Enkele van de belangrijkste toepassingen van aldehyden zijn:
- Ze worden gebruikt bij de productie van oplosmiddelen, verven, cosmetische producten en essences.
- Ze worden gebruikt bij de vervaardiging van harsen. Bakeliet wordt gemaakt met formaldehyde en is een hars die heel goed werkt als elektrische isolator.
- Ze zijn gebruikt als kalmerende middelen. Paraldehyde is gebruikt als kalmerend en hypnoticum, hoewel het nu niet meer wordt gebruikt vanwege de onaangename geur.
- Ze worden gebruikt als conserveermiddel voor biologische monsters en lijken. Formaldehyde wordt in deze zin veel gebruikt.
- Ze worden gebruikt als smaakstoffen voor levensmiddelen. Een voorbeeld is vanilline, dat wordt gebruikt om desserts een vanillearoma te geven.
- Ze worden gebruikt als ontsmettingsmiddelen.
Gevaren van aldehyden
Verschillende aldehyden worden als kankerverwekkend beschouwd. Formaldehyde is bijvoorbeeld volgens de WHO (Wereldgezondheidsorganisatie) tot kankerverwekkende stof verklaard.
Blootstelling aan en contact met veel aldehyden veroorzaakt irritatie van de huid, ogen en luchtwegen. Aan de andere kant veroorzaakt het contactdermatitis en leverziekten.
Referenties
- Solomons, T.W. Graham en María Cristina Sangines Franchini (1985). “organische chemie”Mexico, DF: Limusa.
- Witten, K. W., Gailey, K. D., Davis, R. E., de Sandoval, M. T. NAAR. O., & Muradás, R. M. G. (1992). “Algemene scheikunde" (pag. 108-117). McGraw-Hill.
- Arteaga, P. M. (2017). “Ketonen en aldehyden” Con-Science Wetenschappelijk Bulletin van de voorbereidende school nr. 3, 4(8).
Volgen met:
- Suikers
- Hydraciden
- Ethylalcohol
- Organische en anorganische verbindingen



