Voorbeelden van endotherme reacties
Voorbeelden / / November 09, 2023
A endotherme reactie Het is een reactie waarbij energie uit het medium wordt geabsorbeerd in de vorm van warmte. Om de reactanten in producten te kunnen transformeren, is het bij deze reacties noodzakelijk dat ze warmte absorberen, waardoor de producten meer energie hebben dan de reactanten die er aanleiding toe gaven. Enkele voorbeelden van endotherme reacties zijn: fotosynthese en waterelektrolyse.
- Zie ook: Chemische reacties
Voorbeelden van endotherme reacties in het dagelijks leven
Enkele van de belangrijkste endotherme reacties zijn:
Ozonproductie in de atmosfeer. Ozon wordt in de atmosfeer geproduceerd wanneer moleculaire zuurstof (O2) absorbeert ultraviolette straling en breekt af. Vervolgens kan een zuurstofatoom (O) een interactie aangaan met een ander zuurstofmolecuul (O2) en vormen ozon (O3).

Waterelektrolyse. Het is het proces waarmee het wordt toegepast elektrische energie aan water om het in zijn twee componenten, waterstof (H) en zuurstof (O), te scheiden.
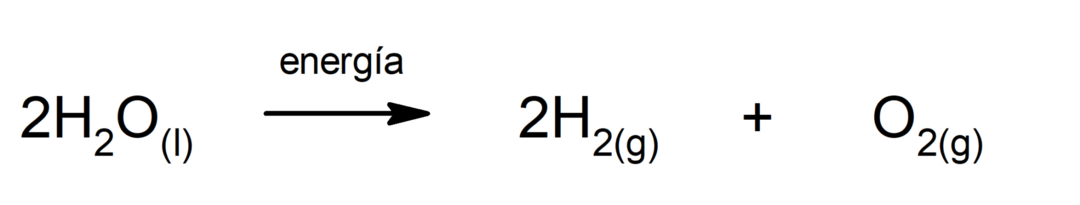
Fotosynthese. Het is de chemische reactie waardoor absorberen
zonne energie, kooldioxide (CO2) wordt omgezet in glucose. Deze reactie vormt de belangrijkste voedingsroute voor planten.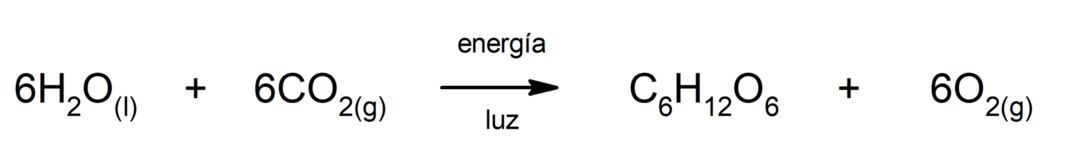
Productie van ijzer(II)sulfide. Om de reactie tussen zwavel en ijzer te laten plaatsvinden, is het noodzakelijk om energie in de vorm van warmte te leveren.
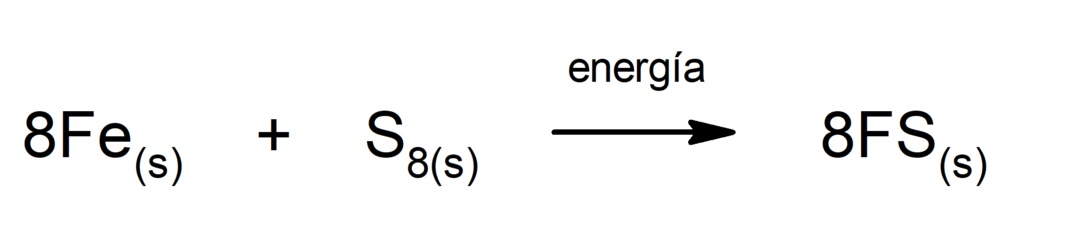
Ontleding van kooldioxide (CO2). De afbraak van CO2 Bij hoge temperaturen produceert het koolmonoxide (CO) en zuurstof (O2).
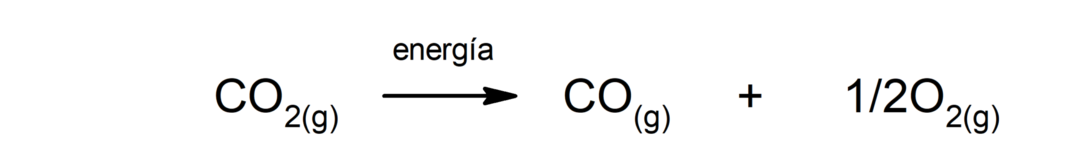
Ontleding van calciumcarbonaat (CaCO3). Calciumcarbonaat ontleedt onder absorptie van warmte en produceert calciumoxide (CaO) en kooldioxide (CO).2).
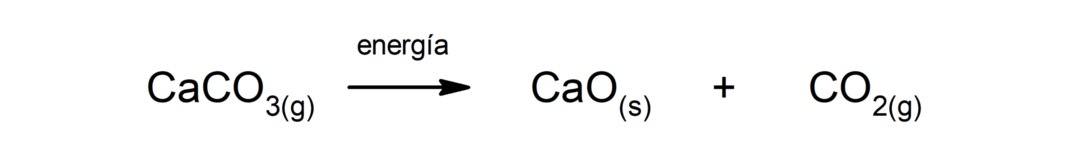
Verschil tussen endotherme en exotherme reactie
Het belangrijkste verschil tussen endotherme en exotherme reacties is dat endotherme reacties warmte absorberen, terwijl exotherme reacties warmte afgeven.
Bovendien worden endotherme reacties gekenmerkt door een toename van de enthalpie, terwijl exotherme reacties gepaard gaan met een afname van de enthalpie.
Enthalpie is een thermodynamische grootheid die de stroom van thermische energie bij constante druk tijdens een chemische reactie definieert. Het wordt weergegeven door de letter H, en de variatie ervan is een van de belangrijkste indicatoren om te bepalen of een chemische reactie endotherm of exotherm is.
- Als een chemische reactie een enthalpieverandering groter dan nul heeft (ΔH > 0) is endotherm.
- Als een chemische reactie een enthalpieverandering heeft van minder dan nul (ΔH<0) is exotherm.
Volgen met:
- Fysisch-chemische verschijnselen
- Chemie in het dagelijks leven
- Chemie in het dagelijks leven
- Organische en anorganische chemie
Referenties
- Soto-Córdoba, S. (2016). Endotherme reacties. Technische opslagplaats Technologisch Instituut van Costa Rica.
- Corominas, J. (2017). Chemische reacties uit het dagelijks leven. Alambiek, (90), 8-26.
- Sanchez, M. T. M., & Sánchez, M. M. (2002). Experimenteel onderzoek naar endotherme reacties voor ESO-studenten. Annalen van de chemie van de RSEQ, (4), 36-39.

