Voorbeeld van peptidebinding
Chemie / / July 04, 2021
De Peptide Bond is degene waarin twee aminozuurmoleculen worden samengevoegd door condensatie.
Om peptidebindingen beter te begrijpen, moeten eerst aminozuren worden gedefinieerd:
De Aminozuren zijn organische moleculen korte met tenminste een aminogroep (-NH2), alkalisch van aard, en een carboxylgroep (-COOH), zuur van karakter.
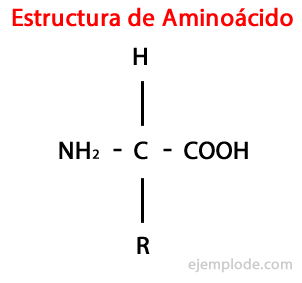
Hoewel levende wezens, voor verschillende doeleinden, zeer diverse soorten aminozuren synthetiseren, zijn de belangrijkste die welke: maken deel uit van eiwitten, die allemaal behoren tot de klasse van de α-aminozuren.
De α-aminozuren worden gekenmerkt doordat de zuur- en aminogroepen aan hetzelfde koolstofatoom zijn gehecht, α-koolstof genaamd. Verder bindt deze α-koolstof als derde substituent een waterstofatoom en als vierde substituent, een extra groep van verschillende grootte en kenmerken, die elk aminozuur onderscheidt van anderen.
De vierde substituent heet Zijketting Aminozuur en wordt vaak in vereenvoudigde vorm weergegeven door de letter R.
Omdat de vier substituenten van de α-koolstof verschillend zijn en er een tetraëdrische rangschikking omheen aannemen, zijn de aanwezige α-aminozuren
optische isomerie, dat is wanneer een molecuul a. heeft alternatieve vorm dat lijkt op een spiegelbeeld his, wat uiteindelijk geen gelijk molecuul is. Deze twee isomere vormen van het molecuul krijgen de letters D of L toegewezen, afhankelijk van hoe de substituenten in de ruimte zijn gerangschikt. Alle aminozuren die in eiwitten zitten zijn L.Aminozuren worden ingedeeld op basis van hun chemische karakter in Polair en Apolair. De Polars zijn op hun beurt onderverdeeld in: Neutraal en opgeladen (die zuur of basisch kan zijn). De Niet-polair kan Alifatisch of Aromatisch zijn.
Peptiden en de peptidebinding
Peptiden zijn het product van de covalente vereniging van aminozuren door middel van amidebindingen, gevormd door condensatie van het carboxyl-uiteinde van het ene en het amino-uiteinde van het andere, waardoor een watermolecuul in de vrijkomt reactie. Deze unie wordt Peptide Bond genoemd.
Het mechanisme van deze reactie wordt hieronder weergegeven, waarbij de Amino- en carboxylgroepen, en de condensatie van de aminozuurmoleculen vindt plaats om het peptide te vormen.
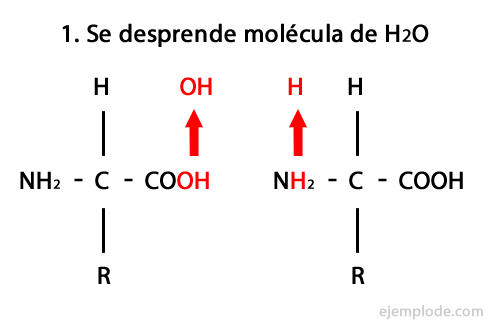
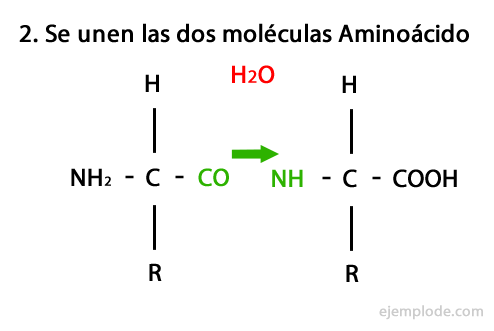

Peptiden, zoals aminozuren en eiwitten, hebben een aminogroep en een carboxylgroep aan hun uiteinden zonder te reageren.
Om de formule van een eenvoudig peptide en zelfs een eiwit te specificeren, volstaat het om de aminozuren op te sommen waaruit het bestaat, beginnend met die met een gratis Aminogroep, en eindigend met degene die zijn Carboxyl-groep gratis presenteert.
Sommige peptiden die in het lichaam worden aangetroffen, zijn de Vasopressine, dat de bloeddruk verhoogt en de waterreabsorptie in de nieren verhoogt; de Enkefaline, die het gevoel van pijn vermindert; en de Oxytocinewaardoor de baarmoeder samentrekt.
Peptide Bond-kenmerken
De condensatie van de aminogroep van het ene aminozuur met het carboxyl van een ander, vindt plaats in waterig oplosmiddel, zodat het is niet spontaan, en daarom vereist eiwitsynthese een toevoer van energie.
De peptidebinding, zoals bij elke amidebinding, presenteert resonantie tussen twee extreme vormen: de neutrale vorm, met een enkele binding die de carbonylkoolstof van het eerste aminozuur en de aminostikstof van het tweede (C-N) verbindt, en het formulier met scheiding van kosten waarin de twee atomen zijn verbonden door een dubbele binding (C = N). In werkelijkheid neemt de peptidebinding geen van de twee extreme situaties aan, maar is het een resonante hybride van beide.
Daar is de oproep Peptide vlak, bestaande uit alle atomen die betrokken zijn bij de Peptide Bond, die de twee initiële aminozuren verbinden. Enerzijds de atomen Stikstof en Waterstof, met hun respectievelijke Koolstof α in het eerste aminozuur. Aan de andere kant de koolstof α van het andere aminozuur, met de zuurstof en koolstof van de carbonylgroep.
Verschillen tussen peptiden en eiwitten
De peptiden hebben een laag aantal aminozuren, die varieert van twee tot enkele tientallen, en hun conformatie in oplossing wordt flexibel.
De kleine eiwitten, structureel dicht bij grote peptiden, hebben a gedefinieerde conformatie en veel minder flexibel.
Er zijn eiwitten die, net als peptiden, een ongeordende en flexibele conformatie hebben, maar die volgorde wanneer ze interageren met andere macromoleculen in de cel.
20 voorbeelden van aminozuren die deelnemen aan Peptide Bonding
- blauweregen
- aan het meisje
- Valine
- Leucine
- isoleucine
- Proline
- Methionine
- fenylalanine
- Tyrosine
- Tryptofaan
- serine
- Threonine
- cysteïne
- Asparagine
- glutamine
- Asparaginezuur
- Glutaminezuur
- Lysine
- Arginine
- histidine