Voorbeeld van reactieve materialen
Chemie / / July 04, 2021
De Reactieve materialen zijn die stoffen die, wanneer ze in contact komen met een ander, de neiging hebben om een chemische reactie starten. Aan het einde van deze reactie is een bepaalde hoeveelheid verschillende stoffen het resultaat.
Reactiviteit in stoffen
De Reactiviteit is de capaciteit van stoffen interactie met anderen bij een chemische reactie. Alle deelnemers aan deze reactie worden Reactief genoemd. Wanneer het chemische fenomeen eindigt, worden verschillende stoffen genoemd Producten.
In de industriële omgeving wordt Reactiviteit gebruikt wanneer u maar wilt een hoeveelheid van een product genereren gezocht. Wat in industriële fabrieken wordt gedaan, is de grondstof kiezen die de juiste reagentia in zijn samenstelling heeft, deze plaatsen in een container genaamd Reactor om de chemische reactie te laten verlopen, en zorg ervoor dat er een economisch proces is en efficiënt.
Er zijn momenten waarop de reactie het zal spontaan zijn, en het zal moeiteloos worden uitgevoerd, gewoon door de reagentia in contact te houden. Het zou alleen nodig zijn om de reagentia te schudden om hun opname te bevorderen.
Bij andere gelegenheden is het simpele contact van de reagentia niet voldoende, maar het zal nodig zijn om de voorwaarden te wijzigen van het proces, ofwel door meer roeren aan de reactor toe te voegen, ofwel verwarming of zelfs koeling in te voeren, zodat de reactie ontstaat en verloopt met een betere snelheid en opbrengst.
De reagentia gaan betrokken raken bij het genereren van producten, maar dat zullen ze doen volgens de verhouding die de vergelijking aangeeft die de reactie uitdrukt, zoals in het volgende:
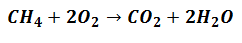
Het betekent dat methaanreagentia (CH4) en zuurstof (O2) zal worden gemengd in een verhouding van 1 tot 2 moleculaire eenheden om de bijbehorende producten te vormen.
Als een van de reagentia wordt toegevoegd aan minste hoeveelheid die vereist is zoals berekend, wordt genoemd Beperkend reagens, want als alles op is, stopt de reactie.
Het andere reagens, dat aan het einde van de reactie een overschot zal zijn, wordt genoemd Reactief in overmaat, en natuurlijk komt het samen met de Producten.
De reactiviteit van stoffen kan voor veel chemische verschijnselen worden gebruikt, zoals: Oxidaties, in het geval van kaliumpermanganaat; katalyse, zoals in het geval van platinametaal in de vorm van een fijnmazige mazen; elementaire uitwisselingen, zoals in het geval van zinkmetaal, dat waterstof in zuren vervangt.
Reactiviteit als eigenschap van gevaarlijke stoffen
De Reactiviteit vertegenwoordigt een riskant eigendom wanneer het reactieve materiaal al een afvalstof is zonder gebruik, wordt het eerst in een container gegoten die ervoor zorgt dat het geïsoleerd blijft van menselijk contact. Wanneer het afval vast of vloeibaar is, bevindt het zich meestal in dikke plastic containers, die verplicht zijn voorzien van een sticker met de pictogram van "Reagensmateriaal", dat is een afbeelding met een oranje achtergrond en de bijbehorende symboliek in het zwart. De volgende afbeelding toont de verscheidenheid aan signalen voor de verschillende soorten reactiviteit.

Reactiviteit is een van de eigenschappen CRETIB van gevaarlijk afval: Bijtend, reactief, explosief, giftig, ontvlambaar en biologisch-infectieus. In feite is het de meest representatieve, omdat alle andere eigenschappen te maken hebben met een wijze van reactiviteit.
Een veel voorkomend geval waarin het gevaar van deze materialen wordt blootgesteld, is wanneer er een lekkage van deze optreedt. Als er bijvoorbeeld een zwavelzuurlek optreedt en het over een zeer groot gebied wordt gemorst, moet personeel dat niet is opgeleid om de situatie onder controle te krijgen, worden verwijderd. Mensen die hierin zijn opgeleid, moeten ingrijpen.
De procedure om de gevaarlijke situatie te elimineren begint door naar de locatie te gaan en de juiste persoonlijke beschermingsmiddelen te dragen. Identificeer en isoleer het gebied van lekkage van het reactieve materiaal en zal de reactiviteit ervan tegengaan met een andere chemisch tegengestelde soort. In dit geval werkt zwavelzuur als een zuur. Het zal mogelijk zijn om deze reactiviteit alleen te doven met een soort zoals natriumhydroxide, een van de krachtigste basen.
De reactie tussen een zuur en een base wordt neutralisatie genoemd. Met behulp van dit fenomeen zal de reactiviteit van het zwavelzuur in het lek worden gericht op de activiteit van het natriumhydroxide.
Er komt een tijd dat natriumhydroxide, ook een reactief materiaal, een einde maakt aan de gevaarlijkheid van zwavelzuur. Als de reactie voorbij is, is het alleen nog een kwestie van de producten verdunnen met een overvloedige stroom water.

Voorbeelden van reactieve materialen
- Natriumhydroxide
- Calcium hydroxide
- Magnesium hydroxide
- Zwavelzuur
- Zoutzuur
- Salpeterzuur
- waterstofsulfide
- Kaliumnitraat
- Natriumbicarbonaat
- Kooldioxide
- Zwaveldioxide
- Zwaveltrioxide
- Hydrogen gas
- gasvormige zuurstof
- Chloor gas
- gasvormig broom
- Metaallithium
- Metallisch natrium
- Metallisch cesium
- Metaalmagnesium
- Ammonium nitraat
- Natriumchloride
- Kaliumchloride
- Calciumchloride
- Kaliumpermanganaat
- Natriumpermanganaat
- Metaal platina
- Metaalzink
- Calciumcarbide
- Acetyleen
- methaan
- ethaan
- Propaan
- Butaan



