Definisjon av molekylær geometri
Miscellanea / / January 11, 2022
Konseptuell definisjon
Det er strukturen til et molekyl som bestemmer det tredimensjonale arrangementet av atomene som utgjør det i rommet.

Kjemisk ingeniør
Molekylære geometrier er for tiden definert basert på Teori av Repulsion of Electronic Pairs of the Valencia Layer (TRPECV). Denne teorien gjør det mulig å forutsi atferden kjemisk av stoffer (spesielt kovalente) og hjelper til med å forstå fordeling elektronikk, som fører til geometri av molekyl. Dette lar oss igjen forstå mange av egenskapene som stoffer får.
Denne teorien er basert på en rekke grunnleggende pilarer som vi vil gjennomgå og deretter prøve å forstå deres applikasjon øve på. For det første er bundne og ubundne (valens) elektroner tenkt på som et hav av elektroner som ved har samme type ladning, de frastøter hverandre, så de vil alltid være plassert så langt unna det sentrale atomet i molekyl.
For det andre danner dette "havet" av elektroner eller "elektroniske skyen" områder med høy elektrontetthet, som er konstituert i bindinger, hvor elektronene er delt eller i elektronpar som ikke er delt. I sin tur kan bindingene som dannes være enkle, doble eller til og med trippel.
Til slutt, for Bestemme seg for molekylær geometri, er det veldig nyttig å ha Lewis-strukturen, hvor mengden elektrontettheter rundt det sentrale atomet vil telles og dette vil gi indikasjon fra navnet på dets geometri og formen som molekylet tar tredimensjonalt.
Det skal bemerkes at disse tetthetene vil være plassert så langt fra hverandre som mulig, for å ta i bruk den mest stabile strukturen og hvor det er mindre frastøting. Slik identifiseres først den elektroniske geometrien og deretter den molekylære geometrien.
Seks nivåer av tetthet
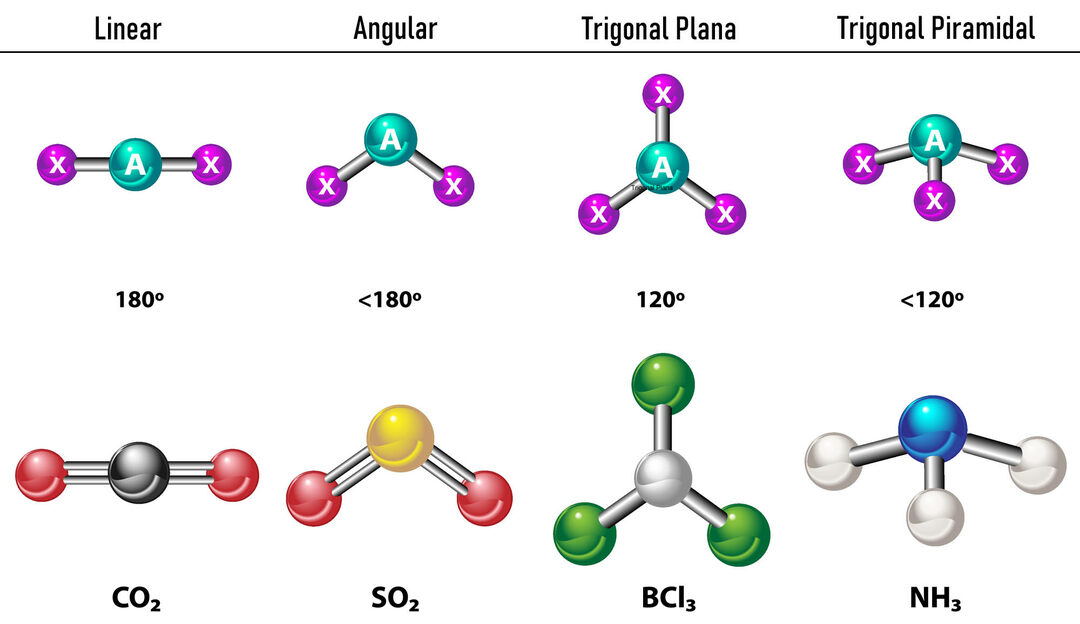
I tilfelle det er to elektrontettheter rundt det sentrale atomet, vil bindingene være plassert så langt fra hverandre mellom dem, det vil si 180º fra hverandre, og derfor er deres elektroniske geometri lineær og molekylært er den også lineær.
I tilfelle det er tre elektrontettheter rundt det sentrale atomet, er det to alternativer: tre bindinger eller to bindinger og ett ubundet par. Hvis det er tre bindinger, er den elektroniske geometrien det Trigonal flat, med 120º vinkler mellom bindinger og molekylær geometri har samme navn. Nå, hvis det er et ikke-bundet par, frastøter de hverandre med mer intensitet at bundne ladninger derfor har en tendens til å komprimere bindingsvinkler. Vinkelen mellom det frie paret og hver binding er 120º og den elektroniske geometrien er Trigonal Plane mens den molekylære geometrien er Angular.
I tilfelle det er fire elektrontettheter rundt det sentrale atomet, er den elektroniske geometrien tetraedrisk. Hvis alle fire elektronpar er bundet sammen, sammenfaller deres molekylære geometri i navn med deres elektroniske geometri og bindingsvinkelen er 109,5º. Nå, hvis ett av parene er fritt, blir bindingsvinkelen mindre (107º) og molekylgeometrien er type Trigonal pyramide. Til slutt, hvis to er frie par og to er bundet, er bindingsvinkelen 104,5º mens molekylgeometrien kalles Kantete.
Når elektrontetthetene rundt det sentrale atomet er fem, kalles det a Trigonal bipyramide dens elektroniske geometri. Hvis alle lastene er koblet sammen, er det vinkler på 120ºC mellom de ekvatorialt plasserte leddene og 90º mellom de aksiale med de ekviatoriske. Nå kalles molekylær geometri også Trigonal Bipyramid mens, med fire koblede par og ett fritt par, er molekylær geometri forvrengt og danner den velkjente "rocker”, Der er navnet den får Forvrengt tetraeder. Mens to av de fem elektronparene er frie og tre av dem er bundet, har den en "T"-formet geometri, og navnet skyldes nettopp strukturen. Til slutt, hvis det er omvendt, tre frie par og to bundne ladninger, er molekylgeometrien lineær.
Til slutt er det seks elektrontettheter rundt det sentrale atomet og et oktaeder dannes, derav navnet i elektronisk geometri. På samme måte er molekylgeometrien navngitt hvis alle parene er koblet sammen. Hvis du har fem koblede par og ett fritt par, er den molekylære geometrien Square Base Pyramid. Hvis du har fire bundne par og to frie par, er molekylgeometrien Square Flat.
Figur: Søt natur
Emner i molekylær geometri