30 Przykłady aldehydów
Przykłady / / November 06, 2023
The aldehydy Czy związki organiczne które składają się z łańcucha węglowego, do którego przyłączona jest końcowa grupa karbonylowa (= C = O) (zlokalizowana na jednym końcu cząsteczka), który z kolei jest związany z atomem wodoru.
Bardzo powszechnymi aldehydami są metanal (formaldehyd), etanal (aldehyd octowy) i propanal (aldehyd propaldehydowy).

Niektóre z tych związków występują w przyrodzie, na przykład wanilina lub wanilina to naturalny aldehyd, który stanowi główny aromat wanilii.
- Zobacz także: Aldehydy i ketony
Nazewnictwo aldehydów
Nazwy aldehydów można stosować zgodnie z zasadami nomenklatury ustanowionymi przez Międzynarodową Unię Chemii Czystej i Stosowanej (IUPAC).
Aby nazwać aldehyd, stosuje się przedrostki wskazujące liczbę atomów węgla, które łańcuch węglowy jest przyłączony do grupy karbonylowej. Grupa karbonylowa zawsze znajduje się na jednym końcu łańcucha węglowego, co oznacza, że zawsze będzie miała pozycję pierwszą i nie ma konieczności wskazywania jej położenia w łańcuchu. Dodatkowo na końcu nazwy aldehydu umieszcza się przyrostek -al. Oto kilka przykładów:
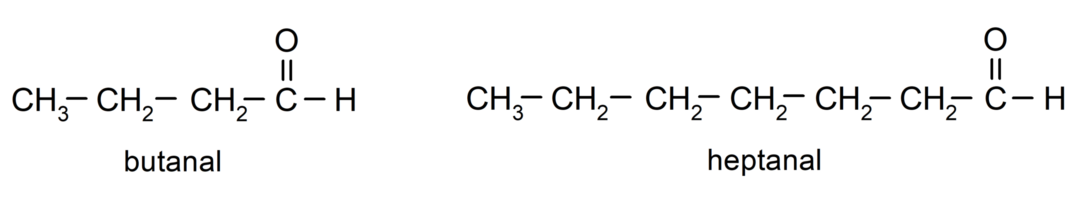
Jeśli aldehyd jest rozgałęziony, to znaczy składa się z kilku łańcuchów węglowych, tzw łańcuch główny jako łańcuch, który ma największą liczbę atomów węgla i który również zawiera grupę karbonyl. Pozostałe łańcuchy nazywane są grupami podstawnikowymi.
Ponadto każdą grupę podstawników należy wybrać tak, aby jej pozycja zajmowała najniższą możliwą numerację w głównym łańcuchu węglowym. Z drugiej strony atomy węgla głównego łańcucha zaczynają być liczone na końcu zawierającym grupę karbonylową. Oto kilka przykładów:
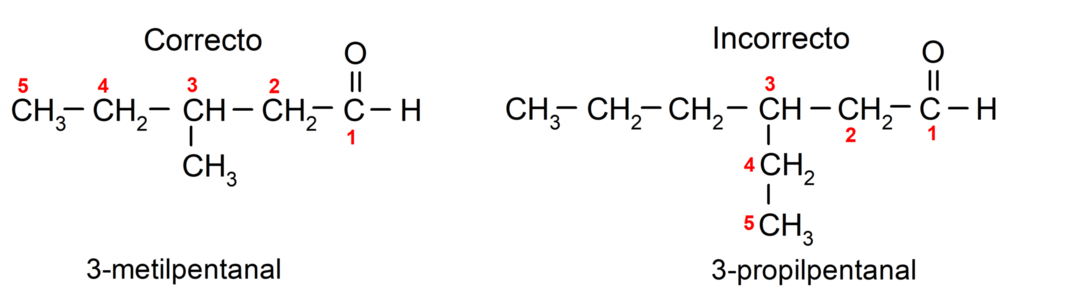
Jeśli aldehyd działa jako podstawnik w cząsteczce, ponieważ jest również zbudowany z grup funkcyjne o wyższym priorytecie, takie jak kwasy i estry, wówczas grupę aldehydową nazywa się -okso. Na przykład:

Jeśli aldehyd ma kilka grup karbonylowych, nazywa się go za pomocą przedrostków wskazujących liczbę tych grup, dial (dwie grupy karbonylowe), próbny (trzy grupy karbonylowe) itp. Na przykład:
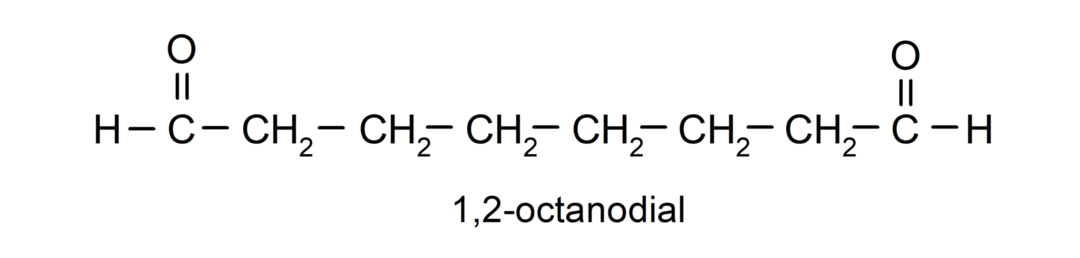
Kiedy grupa karbonylowa jest połączona z cyklem, aldehydy nazywane są za pomocą terminu karbaldehyd. Na przykład:

Właściwości fizyczne aldehydów
Aldehydy zwykle mają pewne odmiany tej samej właściwości fizycznej. Dzieje się tak, ponieważ właściwości fizyczne aldehydów zależą od sposobu tworzenia łańcucha węglowego przyłączonego do grupy karbonylowej.
Niektóre właściwości fizyczne aldehydów to:
- Rozpuszczalność. Rozpuszczalność aldehydów w wodzie zależy od ich ilości atomy który ma łańcuch węglowy. Aldehydy o krótszych łańcuchach węglowych (do około pięciu atomów węgla) są rozpuszczalne w wodzie. Aldehydy posiadające łańcuchy węglowe składające się z wielu atomów węgla nie są rozpuszczalne w wodzie. Metanal i etanal są bardzo dobrze rozpuszczalne w wodzie.
- Gęstość. Ogólnie rzecz biorąc, aldehydy są związkami o mniejszej gęstości niż woda.
- Stany agregacji. Są to aldehydy składające się z jednego i dwóch atomów węgla gazy, te zawierające od trzech do dwunastu atomów węgla to płyny, a te składające się z więcej niż dwunastu atomów węgla są stałe.
- Zapach. Niektóre aldehydy mają drażniący zapach, inne zaś przyjemny.
- Biegunowość. Grupa karbonylowa nadaje im polarność.
- Temperatura wrzenia. Mają wyższą temperaturę wrzenia niż alkany o podobnej masie cząsteczkowej i niższą temperaturę wrzenia niż kwasy karboksylowe i alkohole o porównywalnej masie cząsteczkowej.
Właściwości chemiczne aldehydów
Niektóre właściwości chemiczne aldehydów to:
Aldehydy ulegają utlenieniu w reakcji z odczynnikami Tollensa, Benedicta i Fehlinga. tworząc odpowiedni kwas karboksylowy. Utworzony kwas będzie miał taką samą liczbę atomów węgla w łańcuchu węglowym, jak aldehyd, z którego został utworzony. Na przykład:
- Utlenianie odczynnikiem Tollensa (kompleks srebra amonowego w roztworze zasadowym, [Ag (NH3)2]+). W wyniku tej reakcji powstaje odpowiedni kwas i metaliczne srebro.

- Utlenianie odczynnikiem Benedicta i Fehlinga (alkaliczne roztwory siarczanu miedzi (II) (CuSO4) o różnych składach). W wyniku tej reakcji powstaje odpowiedni kwas i tlenek miedziawy (Cu2ALBO).

Ulegają reakcjom addycji nukleofilowej, gdzie nukleofile są dodawane do grupy karbonylowej aldehydów. Oto kilka przykładów:
- reakcje addycji alkohole do grupy karbonylowej aldehydów, tworząc acetale i półacetale.
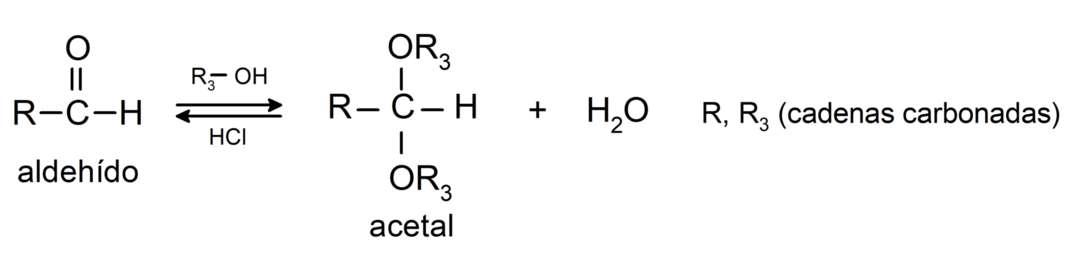
- reakcje addycji aminy pierwszorzędowy względem grupy karbonylowej.

- Reakcje addycji kwasu cyjanowodorowego (HCN), podczas których tworzą się cyjanohydryny lub cyjanohydryny.

Ulegają reakcjom kondensacji aldolowej. W tego typu reakcji dwa aldehydy kondensują, tworząc aldol. Są to reakcje zachodzące z wodorotlenkiem sodu (NaOH). Na przykład:
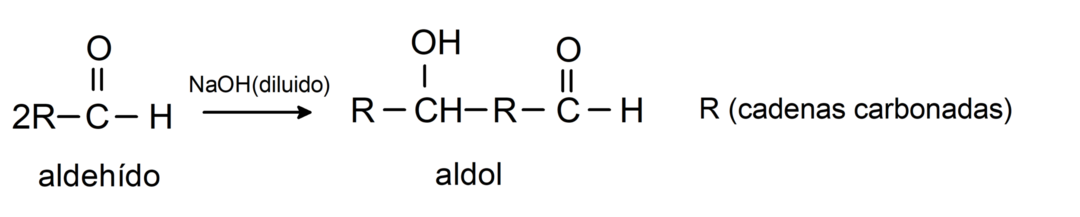
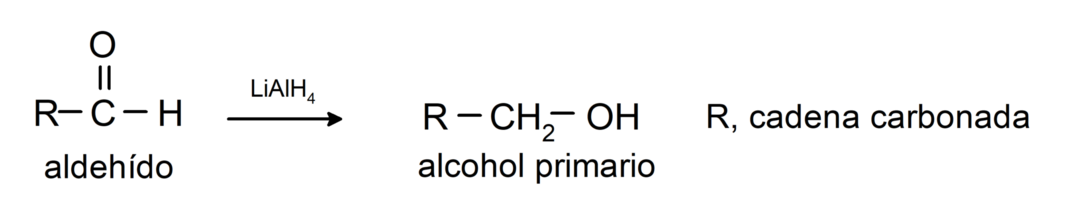
Ulegają reakcjom redukcji do alkoholi pierwszorzędowych. W obecności borowodorku sodu (NaBH4) i wodorku litowo-glinowego (LiAlH4) lub poprzez uwodornienie katalityczne, ulegają one redukcji do alkoholi pierwszorzędowych. Na przykład:
Przykłady aldehydów
- metanal (formaldehyd)
- etanal (aldehyd octowy)
- propanal (propaldehyd)
- butanal
- pentanal
- wanilina
- aldehyd cynamonowy
- propenalny
- benzaldehyd
- heksanal
- 3-bromocyklopentanokarbaldehyd
- cykloheksanokarbaldehyd
- 4,4-dimetylopentanal
- 2-hydroksy-butanal
- 2-hydroksy-2-metylo-butanal
- 2,3-dimetylopentanal
- pentanodialny
- cyklopentanokarbaldehyd
- izobutanal
- 2-chlorobutanal

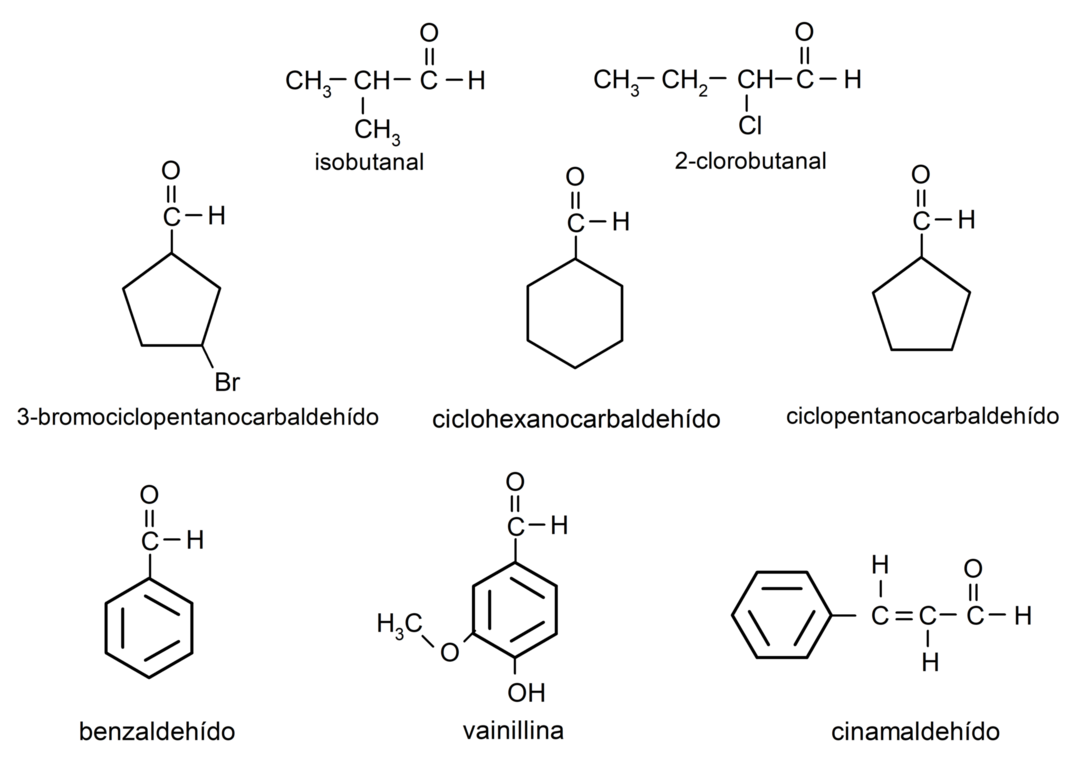
Aldehydy w przyrodzie
Niektóre aldehydy występujące w przyrodzie to:
- Benzaldehyd, składnik migdałów.
- Aldehyd cynamonowy – składnik nadający esencji cynamonowej charakterystyczny zapach.
- Wanilina, składnik nadający wanilii jej smak.
Natomiast jedna z form glukozy, forma otwarta, posiada aldehydową grupę funkcyjną.
Uważa się, że aldehyd octowy, który powstaje jako półprodukt w metabolizmie alkoholu, powoduje objawy kaca po zatruciu alkoholem.
Zastosowania aldehydów
Oto niektóre z głównych zastosowań aldehydów:
- Wykorzystuje się je do produkcji rozpuszczalników, farb, produktów kosmetycznych i esencji.
- Wykorzystuje się je do produkcji żywic. Bakelit wytwarzany jest z formaldehydu i jest żywicą, która bardzo dobrze sprawdza się jako izolator elektryczny.
- Stosowano je jako środki uspokajające. Paraldehyd był używany jako środek uspokajający i nasenny, chociaż obecnie nie jest używany ze względu na nieprzyjemny zapach.
- Stosowane są jako środki konserwujące próbki biologiczne i zwłoki. Formaldehyd jest szeroko stosowany w tym sensie.
- Stosowane są jako aromaty spożywcze. Przykładem jest wanilina, która służy do nadawania deserom aromatu waniliowego.
- Stosowane są jako środki dezynfekcyjne.
Niebezpieczeństwa związane z aldehydami
Kilka aldehydów zostało uznanych za rakotwórcze, na przykład formaldehyd został uznany za związek rakotwórczy według WHO (Światowej Organizacji Zdrowia).
Narażenie i kontakt z wieloma aldehydami powoduje podrażnienie skóry, oczu i dróg oddechowych. Z drugiej strony powoduje kontaktowe zapalenie skóry i choroby wątroby.
Bibliografia
- Solomons, T.W. Graham i María Cristina Sangines Franchini (1985). “Chemia organiczna” Meksyk, D.F.: Limusa.
- Whitten, K. W., Gailey, K. D., Davisa, R. E., de Sandoval, M. T. DO. O. i Muradás, R. M. G. (1992). “Chemia ogólna” (str. 108-117). McGraw-Hill.
- Artega, P. M. (2017). “Ketony i aldehydyBiuletyn Naukowy Con-Science Szkoły Przygotowawczej nr 3, 4(8).
Postępuj zgodnie z:
- Cukry
- Kwasy wodne
- Alkohol etylowy
- Związki organiczne i nieorganiczne



