30 przykładów alkoholi
Przykłady / / November 06, 2023
The alkohole Czy organiczne związki chemiczne które zawierają w swojej strukturze hydroksylową grupę funkcyjną (-OH) przyłączoną do węgla (-C). Grupa (- C – OH) nazywana jest „karbinolem”. Oto kilka przykładów alkoholi: metanol, etanol i 1-propanol.
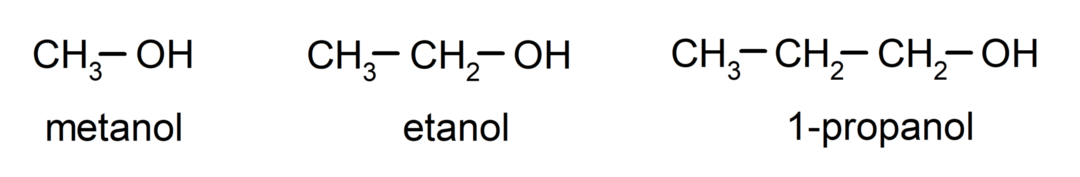
Alkohole to związki chemiczne o różnorodnym zastosowaniu w życiu codziennym, gdyż posiadają właściwości antybakteryjne i antyseptyczne. Z drugiej strony mogą być niebezpieczne dla zdrowia ludzkiego w przypadku niekontrolowanego spożycia.
Podobnie nie wszystkie alkohole mogą być spożywane przez ludzi.
- Zobacz także: Aminy i ketony
Rodzaje alkoholi
W zależności od liczby atomów węgla, do których jest przyłączony atom węgla z przyłączoną grupą hydroksylową, alkohol może być:
- Alkohol pierwotny. Atom węgla, do którego przyłączona jest grupa hydroksylowa, jest również przyłączony do pojedynczego atomu węgla. Na przykład:
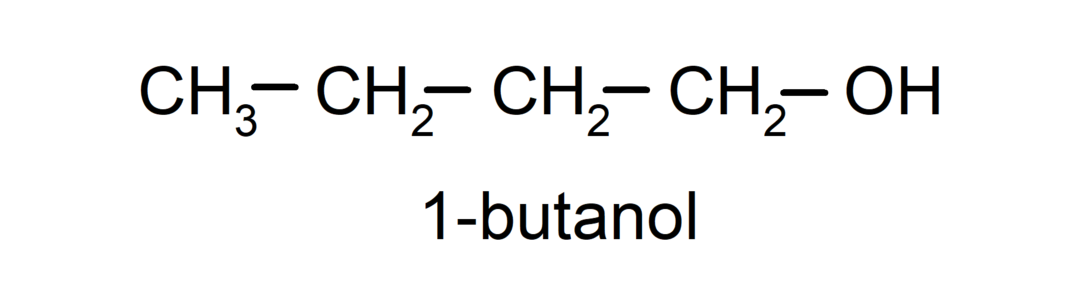
- Alkohol wtórny. Atom węgla, do którego przyłączona jest grupa hydroksylowa, jest także związany z dwoma innymi atomami węgla. Na przykład:
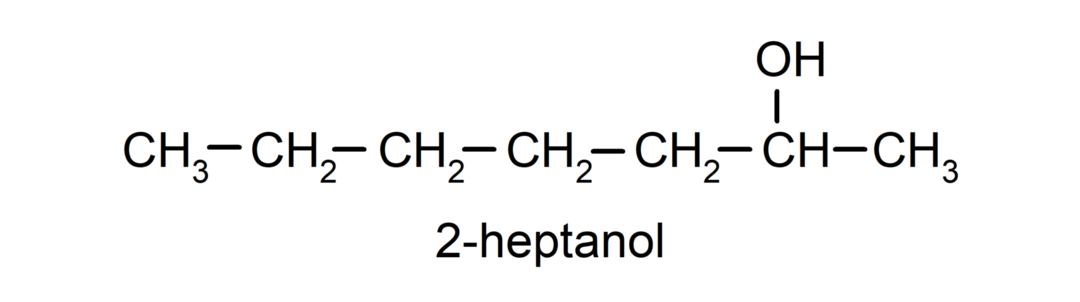
- Alkohol trzeciorzędowy. Atom węgla, do którego przyłączona jest grupa hydroksylowa, jest również przyłączony do trzech atomów węgla. Na przykład:
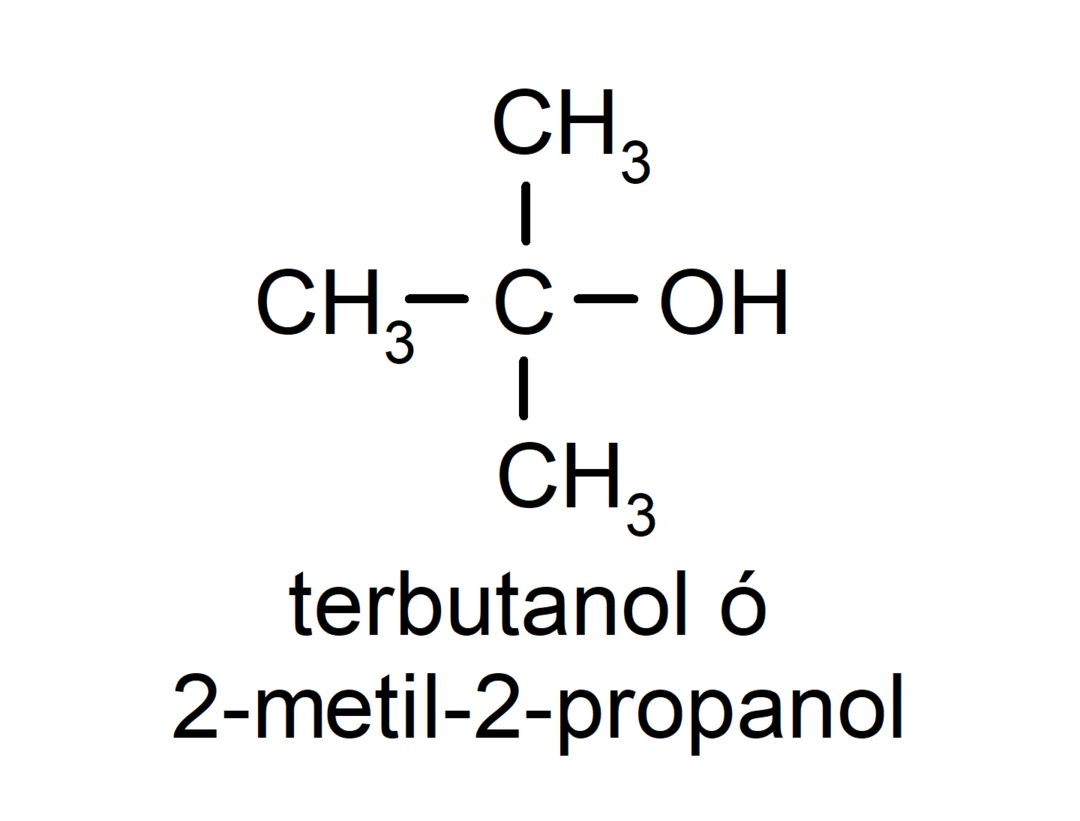
W zależności od liczby grup hydroksylowych alkohol może być:
- Diol. Ma w swojej strukturze dwie grupy hydroksylowe. Na przykład:
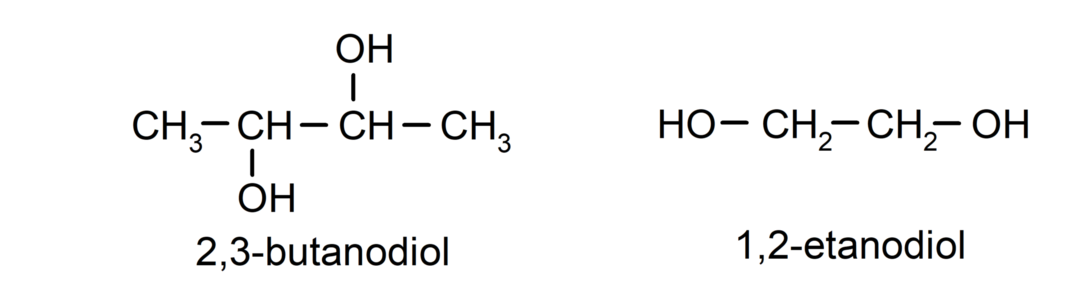
- Triol. Ma w swojej strukturze trzy grupy hydroksylowe. Na przykład:
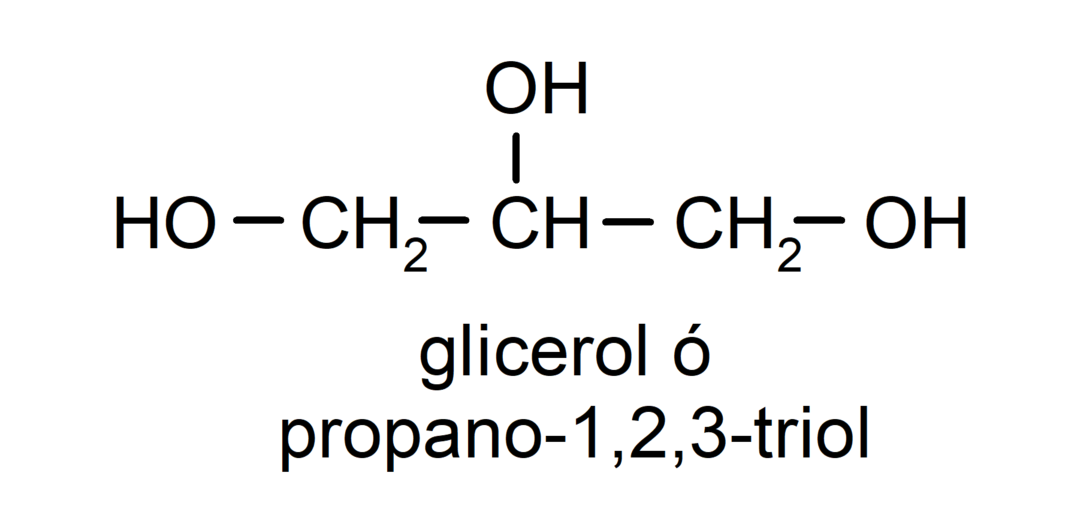
- Polialkohol. Ma w swojej strukturze wiele grup hydroksylowych. Na przykład:
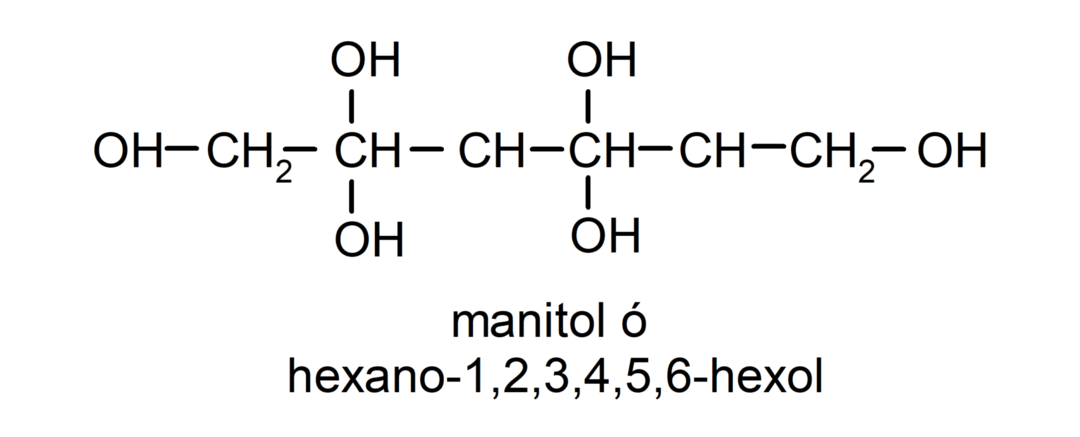
Właściwości fizyczne alkoholi
Niektóre właściwości fizyczne alkoholi to:
- Temperatura wrzenia. Temperatura wrzenia alkoholi jest dość wysoka ze względu na obecność grupy hydroksylowej, która umożliwia tworzenie wiązań wodorowych. Ponadto, im więcej hydroksylowych grup funkcyjnych jest obecnych w łańcuchu węglowym, tym wyższy jest Temperatura wrzenia alkoholi.
- Biegunowość. Alkohole są związkami dość polarnymi.
- Rozpuszczalność. Alkohole o niskiej masie cząsteczkowej są rozpuszczalne w wodzie. Natomiast im większy łańcuch węglowy alkoholi, tym mniejsza jest ich rozpuszczalność w wodzie. Dodatkowo im więcej grup hydroksylowych mają alkohole, tym większa jest ich rozpuszczalność w wodzie.
- Stan skupienia. Większość alkoholi w temperaturze pokojowej (25°C) ma postać cieczy i ma charakterystyczny zapach.
Właściwości chemiczne alkoholi
Niektóre właściwości chemiczne alkoholi to:
- Alkohole zachowują się jak kwasy i zasady.. Ich zachowanie jako kwasów można zaobserwować w reakcjach z aktywnymi metalami, w wyniku których uwalnia się gazowy wodór i tworzą alkoholany.

Ich zachowanie jako zasad można zaobserwować w reakcjach takich jak reakcja metanolu z bromowodorem z wytworzeniem bromku metyloksoniowego.
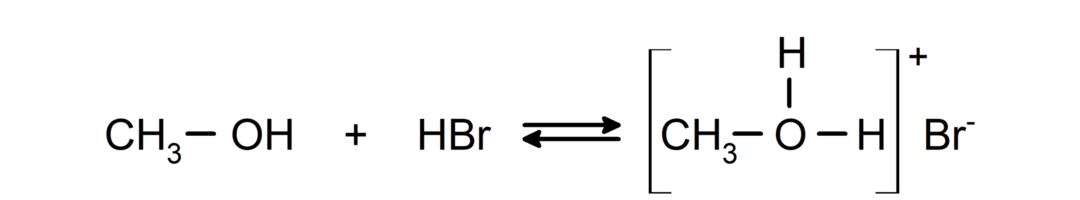
- Alkohole ulegają reakcjom halogenowania. Reagują z halogenowodorami, tworząc halogenki alkilu.
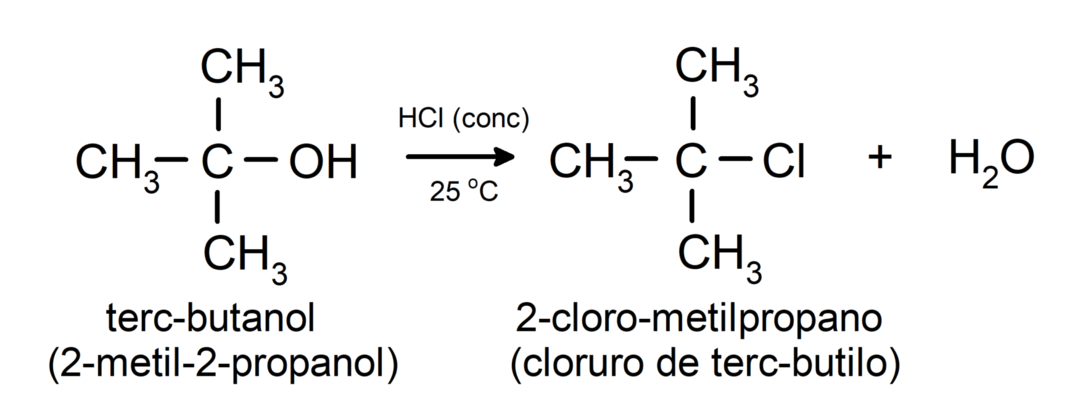
-
Alkohole ulegają reakcjom utleniania gdy reagują z pewnymi związkami utleniającymi. Produkty reakcji utleniania zależą od rodzaju reagującego alkoholu, czyli od tego, czy jest on pierwszorzędowy, drugorzędowy czy trzeciorzędowy.
Utlenianie alkoholu pierwszorzędowego do aldehydu lub kwasu karboksylowego.
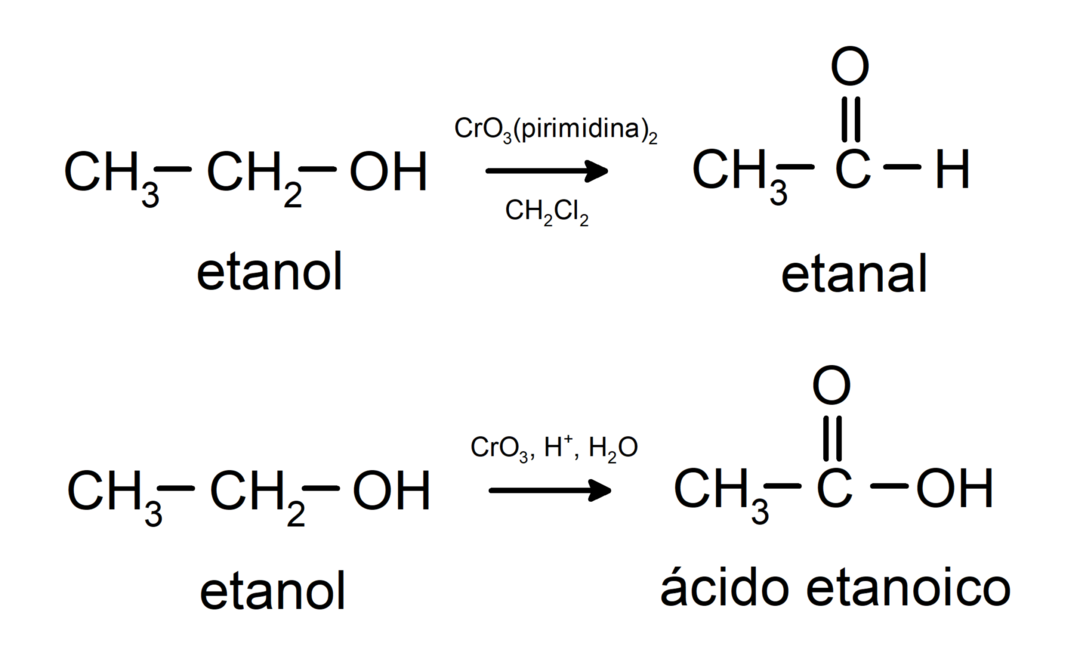
Utlenianie alkoholu wtórnego do ketonu.
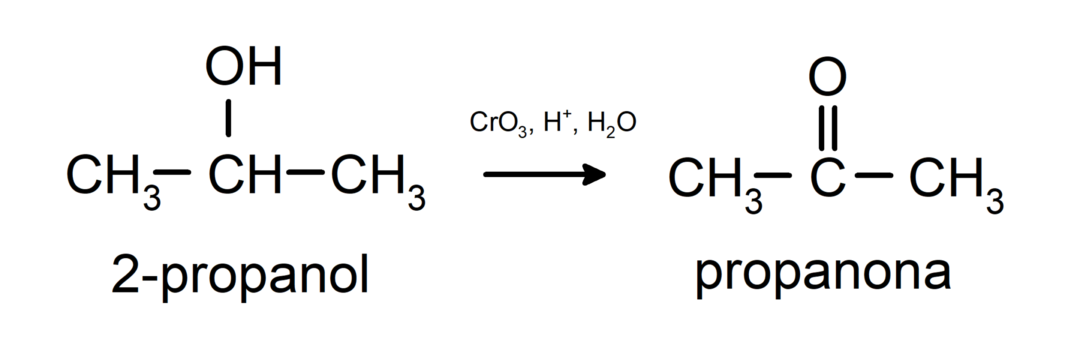
Alkohole trzeciorzędowe nie utleniają się za pomocą zwykłych utleniaczy. Przy pomocy bardzo silnych utleniaczy można je przekształcić w alkeny, które następnie można utlenić.
Alkohole, które mają dwie grupy hydroksylowe zlokalizowane na sąsiednich atomach węgla, utleniają się tetraoctanem ołowiu, tworząc dwa ketony.
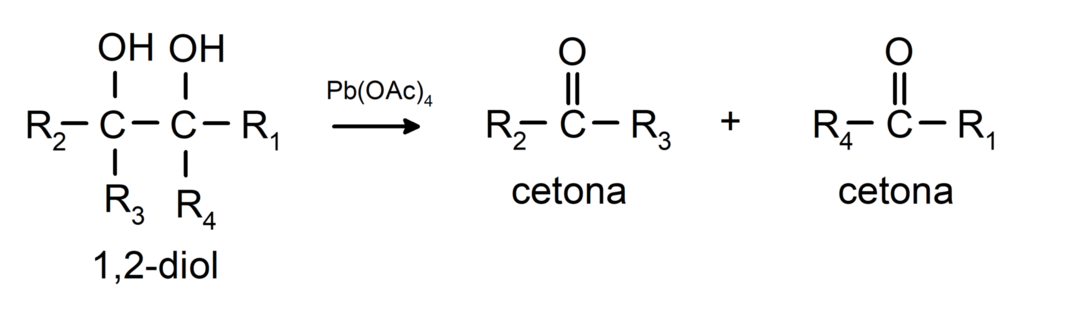
- Alkohole ulegają reakcjom odwodornienia. Reakcje te zachodzą tylko z alkoholami pierwszorzędowymi i drugorzędowymi, które poddawane działaniu wysokich temperatur w obecności katalizatorów uwalniają wodory.
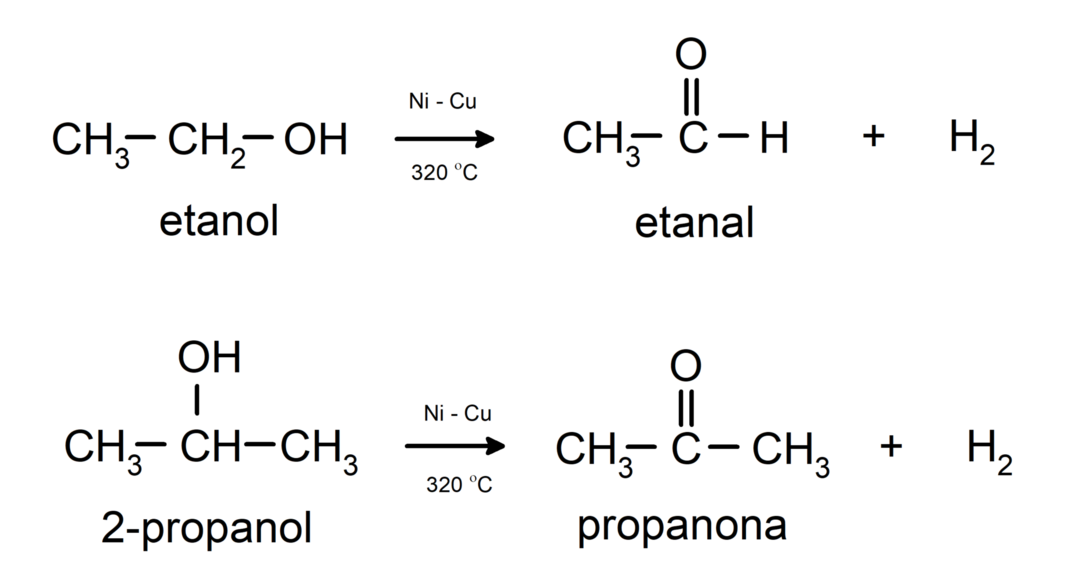
- Alkohole ulegają reakcjom odwodnienia. Alkohole odwadniają się, tworząc odpowiednie alkeny. Reakcja ta zachodzi w obecności kwasu i temperatur pośrednich.
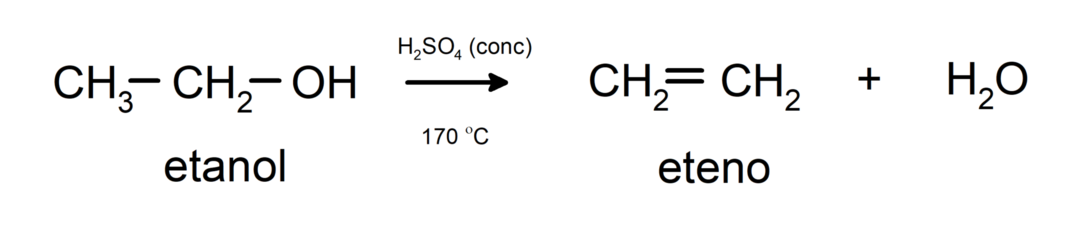
Nazewnictwo alkoholi
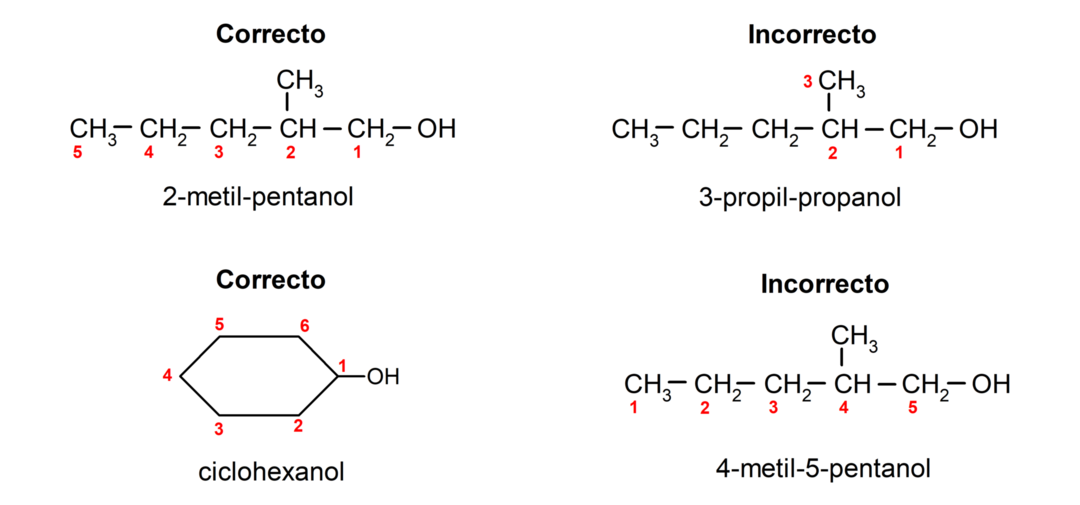
Zgodnie z nomenklaturą ustanowioną przez IUPAC (Międzynarodową Unię Chemii Czystej i Stosowanej) alkohole nadawane są według następujących zasad:
- Pozycję grupy hydroksylowej dobiera się biorąc pod uwagę, że zajmuje ona możliwie najmniejszą liczbę w łańcuchu węglowym. Jeśli struktura alkoholu jest cykliczna, bierze się pod uwagę pozycję 1 na węglu, do którego przyłączona jest grupa hydroksylowa, i do jej nazwy stosuje się przedrostek cyclo-.
- Nazwę alkoholu zapisuje się za pomocą przedrostków wskazujących liczbę atomów w łańcuchu węglowym, a dodatkowo umieszcza się przyrostek -ol.
- Jeśli struktura alkoholu ma rozgałęzienia, jako główny łańcuch węglowy wybiera się najdłuższy łańcuch, który zawiera również grupę hydroksylową.
Zgodnie z tradycyjną nomenklaturą nazwy alkoholi nadawane są poprzez wpisanie słowa „alkohol”, a następnie nazwy alkoholu. alkan odpowiadający łańcuchowi węglowemu, ale zamiast stosować końcówkę -an alkanu, końcówkę -yllic.
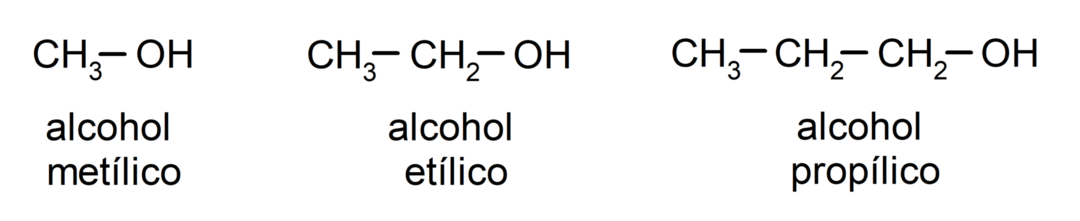
Przykłady alkoholi
- metanol
- etanol
- 1-propanol
- 2-propanol
- 1-butanol
- 3-etyloheksan-2-ol
- glicerol
- fenol
- 2-metylo-2-butanol
- 1,2-etanodiol
- 1,5-heptadien-3-ol
- 3-metylo-2-butanol
- benzylometanol
- 3-pentanol
- 2-metylofenol
- 1,2-dihydroksyfenol
- cykloheknol
- 1-fenyloetanol


Zastosowania alkoholi
Najczęstsze zastosowania alkoholi to:
- Stosowane są jako środki dezynfekujące i antyseptyczne, ponieważ hamują wzrost niektórych z nich mikroorganizmy lub je zniszczyć. Najczęściej stosuje się w tym celu etanol i alkohol izopropylowy.
- Wykorzystuje się je w syntezie różnych związki chemiczne. Na przykład metanol wykorzystuje się do otrzymywania metanolu (formaldehydu).
- Wykorzystuje się je do produkcji środków przeciw zamarzaniu. Metanol jest jednym z najczęściej używanych do tego celu.
- Stosowane są jako rozpuszczalniki w przemyśle farmaceutycznym. Etanol jest jednym z najczęściej używanych w tym sensie.
- Stosowane są jako rozpuszczalniki do lakierów, barwników i tuszy. W tym celu powszechnie stosuje się metanol.
- Wykorzystuje się je jako paliwo i istnieje wyraźna tendencja do ich częściowego zastąpienia paliwa kopalne poprzez wykorzystanie paliwa bioetanolowego.
- Wykorzystuje się je do produkcji żywic. W tym sensie stosuje się fenol.
Niebezpieczeństwa związane ze spożywaniem alkoholu
Chociaż spożycie alkoholu jest dziś społecznie akceptowane, nadużywanie tej substancji powoduje uzależnienie i uzależnienie.
Etanol to alkohol obecny w napojach alkoholowych, który spożywany w nadmiarze szkodzi zdolności poznawcze i może powodować choroby układu krążenia, marskość wątroby i rak.
Ponadto w przypadku osiągnięcia stopnia upojenia alkoholowego, czyli stanu upojenia alkoholowego, jeżeli dawka leku alkoholu jest za dużo, może wystąpić śpiączka alkoholowa, która może prowadzić do paraliżu oddechowego, a nawet śmierci. śmierć.
Bibliografia
- T. DO. Geissmana. (1974) „Zasady chemii organicznej”, wydanie drugie. Redakcja Reverté, SA ISBN: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E. i Valdez-Montero, C. (2017). Spożywanie alkoholu jako problem zdrowia publicznego. Ra Ximhaia, 13(2), 13-24.
- Morrisona, R. T. i Boyd, R. N. (1998). Chemia organiczna. Edukacja Pearsona.
- Weiningera, S. J. i Stermitz, F. R. (1988). Chemia organiczna. odwróciłem się.
Postępuj zgodnie z:
- Alkohol etylowy
- Paliwa
- Chemia organiczna

