Conceito na Definição ABC
Miscelânea / / April 22, 2022
definição de conceito
Os azeótropos são misturas de compostos químicos, com uma composição definida, que fervem a determinadas temperaturas. A característica fundamental é que a mistura se comporta como se fosse uma única substância pura, conservando suas propriedades e proporcionando facilidade de manuseio.

Engenharia Química
A mistura pode ser dada por dois ou mais componentes e sua composição é o mesmo tanto na fase líquida quanto na fase gasosa, o que gera semelhanças com substâncias puras. A partir disso, é fácil deduzir que essa mistura não pode ser separada em seus componentes por processos como destilações fracionadas, pois, conforme mencionado acima, manterá suas proporções, comportando-se como se fosse uma única componente.
Outra característica é que o ponto de ebulição dessa mistura pode ser maior, menor ou mesmo igual ao de um de seus componentes. Quando o azeótropo ferve a uma temperatura de ebulição máxima, é conhecido como azeótropo máximo e quando o faz na temperatura mais baixa possível é conhecido como azeótropo mínimo. Isso significa que o azeótropo mínimo tem um ponto de ebulição mais baixo do que seus componentes puros e vice-versa com o azeótropo máximo. Por exemplo, na mistura metanol - benzeno, o azeótropo é mínimo (0,61 benzeno - 0,39 metanol em frações molar) cujo ponto de ebulição é 58°C, em um tanque onde o ponto de ebulição do benzeno é 80°C e o do metanol 65°C
Azeótropos mínimo e máximo
Agora… de onde vem um azeótropo? Quando há um desvio da Lei Raoult, ou seja, a pressão de vapor da mistura azeotrópica não está diretamente relacionada à sua fração molar, é quando surge o conceito de mistura azeotrópica. Esses desvios ocorrem quando os componentes se atraem ou se repelem significativamente, ou seja, as forças intermoleculares são muito diferentes em diferentes compostos.
Quando o desvio é positivo, temos o azeótropo mínimo, enquanto se o desvio for negativo, temos o azeótropo máximo. Para entender melhor esse conceito, vejamos alguns gráficos:
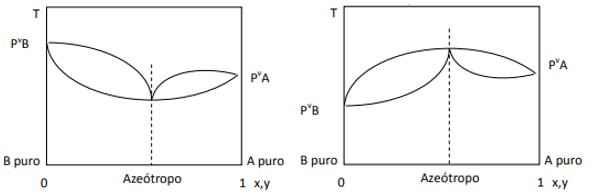
Aqui observamos que, se a mistura fosse ideal, pela Lei de Raoult, as pressões de vapor dos componentes puros deveriam ser unidas por uma linha reta, pois bem, há um desvio dessa lei que causa a formação de azeótropos mínimo e máximo, dependendo se há maior ou menor afinidade entre os componentes. Quando o desvio da lei de Raoult é negativo, como na figura à esquerda, é mínimo em diagrama de pressão, mas um máximo no diagrama de temperatura (portanto, azeótropo de máximo). Por outro lado, se o desvio for positivo para a Lei de Raoult, será um máximo na pressão vs. composição, mas um mínimo no diagrama de temperatura vs. composição (aqui temos um azeótropo mínimo). Não confunda diagramas de pressão vs. composição e temperatura vs. composição.
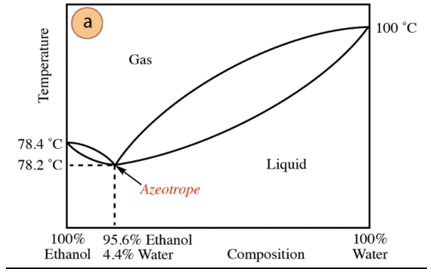
No caso da mistura etanol-água, existe um azeótropo mínimo cuja composição é de 95,6% de etanol e 4,4% de água. A temperatura de ebulição da mistura azeotrópica é 78,2°C inferior à dos componentes puros. Então, suponha destilar uma mistura água-etanol com alto teor de água (próximo de 100%). Não será possível obter álcool puro, pois em cada etapa de destilação serão obtidas frações maiores. de etanol, mas nunca chegando a 100%, vai se aproximando gradativamente da composição da mistura azeotrópica (o ponto mais baixo debaixo). É por isso que, como a água, tem tendência a formar azeótropos mínimos com compostos orgânicos (dado o tipo de forças intermoleculares que interagem), é necessário remover previamente a água da mistura para obter o composto puro. Ou, uma vez obtido o azeótropo, métodos de Extração de água adicional.
Com base no exposto, não é por acaso encontrar álcool (no supermercado e farmacia) a 95%, é o produto mais barato que pode ser obtido. Para obter álcool puro, é necessário "quebrar" o azeótropo com técnica adicionais, como o uso de agentes de secagem ou destilações azeotrópicas. A destilação azeotrópica consiste na adição de um componente extra à mistura que atua por arrastamento e por interação com qualquer um dos componentes da mistura (maior afinidade) pode ser removido da mistura.
Tópicos em Azeótropos


