30 exemplos de aldeídos
Exemplos / / November 06, 2023
O aldeídos são compostos orgânicos que são formados por uma cadeia de carbono que possui um grupo carbonila terminal (= C = O) ligado (localizado em uma extremidade do molécula), que por sua vez está ligado a um átomo de hidrogênio.
Aldeídos muito comuns são metanal (formaldeído), etanal (acetaldeído) e propanal (propaldeído).

Alguns destes compostos estão presentes na natureza, por exemplo, a vanilina ou vanilina é um aldeído natural que constitui o principal aromatizante da baunilha.
- Veja também: Aldeídos e cetonas
Nomenclatura de aldeídos
Os aldeídos podem ser nomeados usando as regras de nomenclatura estabelecidas pela União Internacional de Química Pura e Aplicada (IUPAC).
Para nomear um aldeído, são usados prefixos que indicam o número de átomos de carbono que a cadeia de carbono ligou ao grupo carbonila. O grupo carbonila está sempre localizado em uma extremidade da cadeia carbônica, o que significa que sempre terá a posição um e não é necessário indicar sua localização na cadeia. Além disso, o sufixo -al é colocado no final do nome do aldeído. Alguns exemplos são:
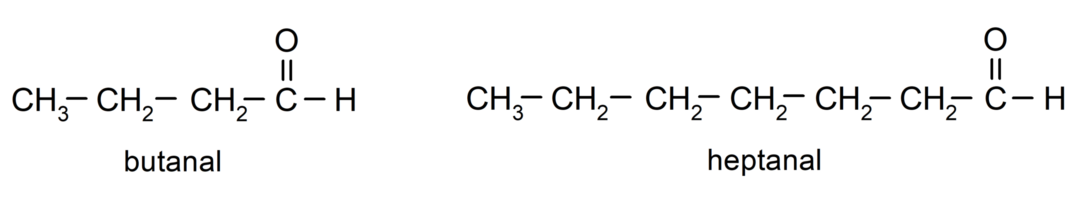
Se o aldeído for ramificado, ou seja, composto por diversas cadeias de carbono, o cadeia principal como a cadeia que possui o maior número de átomos de carbono, e que também contém o grupo carbonila. O resto das cadeias são denominadas grupos substituintes.
Além disso, cada grupo substituinte deve ser escolhido de forma que sua posição ocupe a numeração mais baixa possível na cadeia carbônica principal. Por outro lado, os átomos de carbono da cadeia principal começam a ser contados na extremidade que contém o grupo carbonila. Alguns exemplos são:
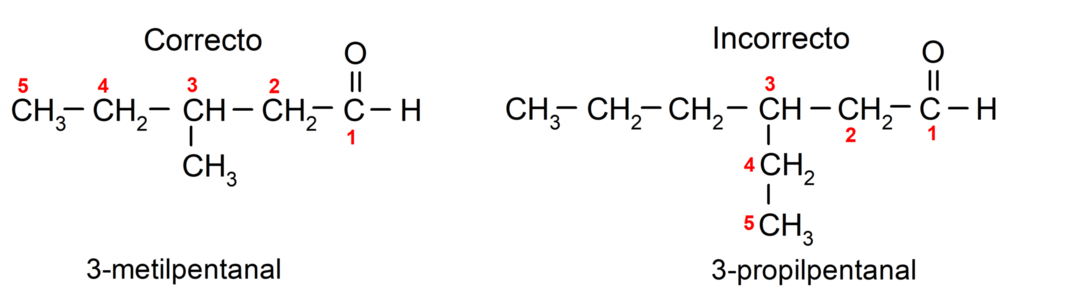
Se o aldeído atua como substituinte na molécula, porque também é formado por grupos funcionais de maior prioridade, como ácidos e ésteres, então o grupo aldeído é denominado -oxo. Por exemplo:

Se um aldeído possui vários grupos carbonila, ele é nomeado usando prefixos que indicam o número desses grupos, dial (dois grupos carbonila), teste (três grupos carbonila), etc. Por exemplo:
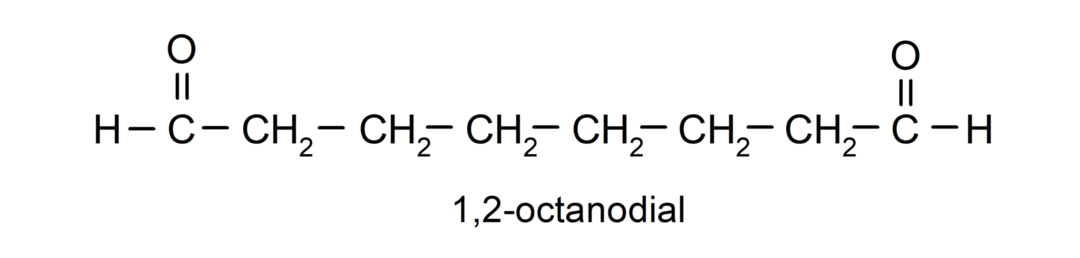
Quando o grupo carbonila está ligado a um ciclo, os aldeídos são nomeados pelo termo carbaldeído. Por exemplo:

Propriedades físicas dos aldeídos
Os aldeídos geralmente apresentam alguma variação da mesma propriedade física. Isso ocorre porque as propriedades físicas dos aldeídos dependem de como se forma a cadeia de carbono que está ligada ao grupo carbonila.
Algumas propriedades físicas dos aldeídos são:
- Solubilidade. A solubilidade em água dos aldeídos depende da quantidade de átomos que tem a cadeia de carbono. Aldeídos com cadeias de carbono mais curtas (até cerca de cinco átomos de carbono) são solúveis em água. Aldeídos com cadeias de carbono de muitos átomos de carbono não são solúveis em água. Metanal e etanal são muito solúveis em água.
- Densidade. Em geral, os aldeídos são compostos menos densos que a água.
- Estados de agregação. Aldeídos compostos por um e dois átomos de carbono são gases, aqueles que contêm entre três e doze átomos de carbono são líquidos, e aqueles compostos por mais de doze átomos de carbono são sólidos.
- Cheiro. Alguns aldeídos apresentam odores irritantes, enquanto outros apresentam odores agradáveis.
- Polaridade. O grupo carbonila lhes confere polaridade.
- Ponto de ebulição. Eles têm pontos de ebulição mais elevados que os alcanos de peso molecular semelhante e têm pontos de ebulição mais baixos que os ácidos carboxílicos e álcoois de peso molecular comparável.
Propriedades químicas dos aldeídos
Algumas das propriedades químicas dos aldeídos são:
Os aldeídos são oxidados quando reagem com os reagentes de Tollens, Benedict e Fehling. para formar o ácido carboxílico correspondente. O ácido formado terá o mesmo número de carbonos na cadeia de carbono que o aldeído a partir do qual foi formado. Por exemplo:
- Oxidação com reagente de Tollens (complexo de prata amoniacal em solução básica, [Ag (NH3)2]+). Esta reação produz o ácido correspondente e a prata metálica.

- Oxidação com reagente Benedict e Fehling (soluções alcalinas de sulfato de cobre (II) (CuSO4) com composições diferentes). Esta reação produz o ácido correspondente e o óxido cuproso (Cu2QUALQUER).

Eles sofrem reações de adição nucleofílica, onde os nucleófilos são adicionados ao grupo carbonila dos aldeídos. Alguns exemplos são:
- reações de adição álcoois ao grupo carbonila dos aldeídos para formar acetais e hemiacetais.
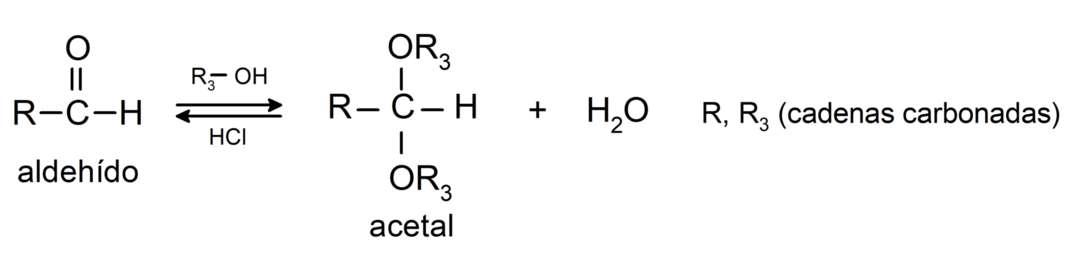
- reações de adição aminas primário ao grupo carbonila.

- Reações de adição de ácido cianídrico (HCN), onde se formam cianidrinas ou cianidrinas.

Eles sofrem reações de condensação aldólica. Neste tipo de reação, dois aldeídos se condensam para formar um aldol. São reações que ocorrem com o hidróxido de sódio (NaOH). Por exemplo:
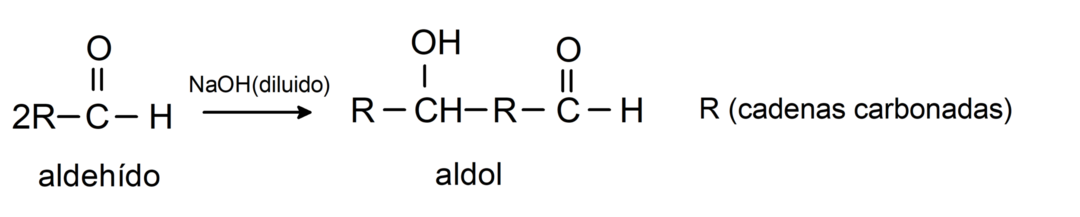
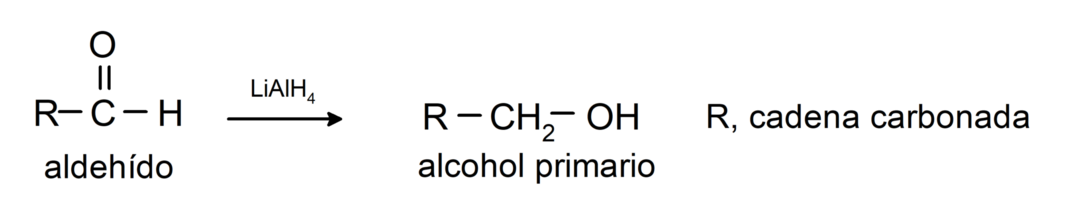
Eles sofrem reações de redução a álcoois primários. Na presença de borohidreto de sódio (NaBH4) e hidreto de alumínio e lítio (LiAlH4) ou por hidrogenação catalítica, são reduzidos a álcoois primários. Por exemplo:
Exemplos de aldeídos
- metanal (formaldeído)
- etanal (acetaldeído)
- propanal (propaldeído)
- Butanal
- pentanal
- vanilina
- cinamaldeído
- propenal
- benzaldeído
- hexanal
- 3-bromociclopentanocarbaldeído
- ciclohexanocarbaldeído
- 4,4-dimetilpentanal
- 2-hidroxi-butanal
- 2-hidroxi-2-metil-butanal
- 2,3-dimetilpentanal
- pentanodial
- ciclopentanocarbaldeído
- isobutanal
- 2-cloro-butanal

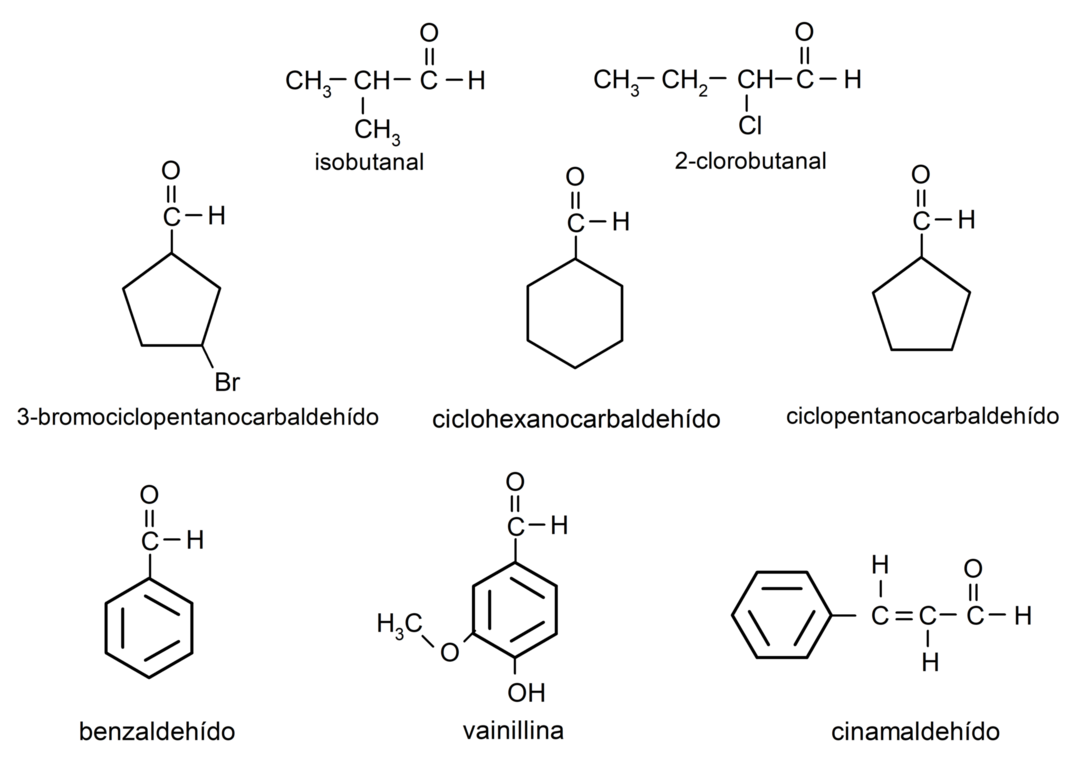
Aldeídos na natureza
Alguns aldeídos presentes na natureza são:
- Benzaldeído, um componente das amêndoas.
- Cinnamaldeído, componente que dá cheiro à essência da canela.
- Vanilina, componente que dá sabor à baunilha.
Por outro lado, uma das formas de glicose, a forma aberta, possui um grupo funcional aldeído.
Acredita-se que o acetaldeído, que é formado como intermediário na metabolização do álcool, causa sintomas de ressaca quando intoxicado por álcool.
Usos de aldeídos
Alguns dos principais usos dos aldeídos são:
- São utilizados na produção de solventes, tintas, produtos cosméticos e essências.
- São utilizados na fabricação de resinas. A baquelite é feita com formaldeído e é uma resina que funciona muito bem como isolante elétrico.
- Eles têm sido usados como sedativos. O paraldeído tem sido usado como sedativo e hipnótico, embora esteja fora de uso devido ao seu odor desagradável.
- Eles são usados como conservantes para amostras biológicas e cadáveres. O formaldeído é amplamente utilizado nesse sentido.
- Eles são usados como aromatizantes alimentares. Um exemplo é a vanilina, usada para dar aroma de baunilha às sobremesas.
- Eles são usados como agentes desinfetantes.
Perigos dos aldeídos
Vários aldeídos foram considerados cancerígenos, por exemplo, o formaldeído foi declarado um composto cancerígeno segundo a OMS (Organização Mundial da Saúde).
A exposição e o contato com muitos aldeídos causam irritação na pele, olhos e trato respiratório. Por outro lado, causa dermatites de contato e doenças hepáticas.
Referências
- Salomão, T.W. Graham e María Cristina Sangines Franchini (1985). “Quimica Organica”México, DF: Limusa.
- Whitten, K. W., Gailey, K. D., Davis, R. E., de Sandoval, M. T. PARA. O., & Muradás, R. M. g. (1992). “Química Geral" (pág. 108-117). McGraw-Hill.
- Arteaga, P. M. (2017). “Cetonas e aldeídos” Boletim Científico Con-Science da Escola Preparatória nº 3, 4(8).
Siga com:
- Açúcares
- Hidrácidos
- Álcool etilico
- Compostos orgânicos e inorgânicos
