Exemplo de ligação covalente
Química / / July 04, 2021
O Ligação covalente é aquele em que dois átomos se unem compartilhando seus elétrons, para ir completando suas Regras do Octeto.
História do vínculo covalente
Foi no início do século 20 que os químicos começaram a entender como e por que as moléculas se formaram. O primeiro grande avanço veio com a proposição de Gilbert Lewis de que a formação de uma ligação química implica que átomos compartilham elétrons. Lewis descreveu a formação de uma ligação química no hidrogênio como:
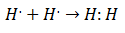
Este tipo de emparelhamento de elétrons é um exemplo de uma ligação covalente, uma ligação em que dois elétrons são compartilhados por dois átomos. O Compostos Covalentes Eles são isso contém apenas ligações covalentes.
Elétrons na ligação covalente
Para simplificar, o par de elétrons compartilhados é frequentemente representado como única linha conectando os símbolos dos elementos. Assim, a ligação covalente da molécula de hidrogênio é escrita como H-H.
Na ligação covalente, cada elétron do par compartilhado é atraído pelos núcleos de ambos os átomos
. Essa atração mantém os dois átomos da molécula H juntos.2 e é responsável pela formação de ligações covalentes em outras moléculas.Nas ligações covalentes entre átomos de vários elétrons apenas elétrons de valência participam, que são os mais externos, no orbital mais raso. Entre um e três deles participarão do sindicato.
Os outros elétrons, que não participam da ligação, são chamados Elétrons Não Ligantes, ou se os organizarmos em pares, Pares Livres. Ou seja, pares de elétrons de Valência que não participe da formação de ligação covalente.
Representação de vínculo covalente
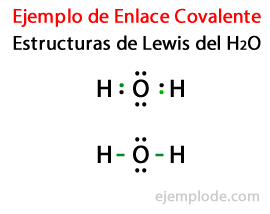
As estruturas com as quais os compostos covalentes são representados, como H2 e F2 são conhecidos como Estruturas de Lewis. Uma estrutura de Lewis é um representação de uma ligação covalente, onde o par de elétrons compartilhados indicado por linhas ou como pares de pontos entre dois átomos, e os pares livres não compartilhados são indicados como pares de pontos nos átomos individuais. Em uma estrutura de Lewis, apenas os elétrons de valência são mostrados, e não os internos.
Considerando a estrutura de Lewis para a molécula de água H2Ou todos os elétrons de valência dos átomos de hidrogênio e oxigênio são marcados primeiro com pontos.
Em um segundo caso, o link é marcado com uma linha. E os pares livres, que existirão apenas em Oxigênio, com pontos.
A regra do octeto
A formação dessas moléculas, como as da Água H2Ou ilustrar a ligação Regra do octeto, proposto por Lewis: Um átomo diferente de hidrogênio tende a formar ligações até se envolver com oito elétrons de valênciaOu seja, uma ligação covalente se forma quando não há elétrons suficientes para cada átomo individual completar seu octeto.
Ao compartilhar elétrons em uma ligação covalente, cada átomo completa seu octeto. Para o hidrogênio, o requisito é que você obtenha a configuração eletrônica do hélio, que deve ter um total de dois elétrons.
A regra do octeto funciona principalmente para os elementos do segundo período ou linha da tabela periódica. Esses elementos têm subníveis nos quais pode haver um total de oito elétrons.
Quando um átomo desses elementos forma um Composto Covalente, ele obtém a configuração eletrônica do Gás Nobre Neon, compartilhando elétrons com outros átomos do mesmo composto.
Tipos de ligações covalentes
Os átomos podem formar diferentes tipos de ligações covalentes: Individuais, Duplos ou Triplos.
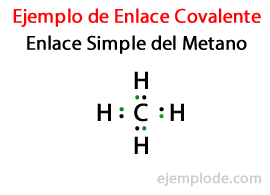
Em um Link Simples, dois átomos são unidos por meio de Um par de elétrons. Eles ocorrem na grande maioria dos compostos covalentes e é a forma mais básica dessa ligação.
Em muitos compostos, Links Duplos, isto é, quando dois átomos compartilham Dois pares de elétrons. Se dois átomos compartilham dois pares de elétrons, a ligação covalente é chamada de ligação dupla. Essas ligações são encontradas em moléculas como o Dióxido de Carbono (CO2) e etileno (C2H4).

UMA Triple Link surge quando dois átomos compartilham Três pares de elétrons, como na molécula de nitrogênio N2, a molécula de acetileno C2H2.

As ligações múltiplas são mais curtas do que as ligações covalentes simples. O Comprimento do link é definido como o distância entre o núcleo de dois átomos unidos por uma ligação covalente em uma molécula.
Diferenças entre compostos covalentes e iônicos
Os compostos iônicos e covalentes apresentam diferenças marcantes em suas propriedades físicas gerais, devido ao fato de suas ligações serem de natureza diferente.
Nos Compostos Covalentes existir dois tipos de forças atrativas; uma delas é aquele que mantém juntos os átomos de uma molécula. Uma medida quantitativa dessa atração é o energia de ligação. A outra força de atração opera entre as moléculas completas e é chamada Força intermolecular. Como as forças intermoleculares são geralmente mais fracas do que as forças que mantêm os átomos de uma molécula juntos, as moléculas de um composto covalente se ligam com menos força.
Em consequência, compostos covalentes são quase sempre gases, líquidos ou sólidos de baixo ponto de fusãon. Por outro lado, as forças eletrostáticas que mantêm os íons juntos em um composto iônico, eles são geralmente muito fortes, de modo que os compostos iônicos sejam sólidos à temperatura ambiente e tenham altos pontos de fusão. Muitos compostos iônicos são solúveis em água e suas soluções aquosas conduzem eletricidade porque esses compostos são eletrólitos fortes.
A maioria dos compostos covalentes são insolúveis em água, e se eles se dissolverem, suas soluções aquosas em geral eles não conduzem eletricidade porque esses compostos são não eletrólitos. Os compostos iônicos derretidos conduzem eletricidade porque contêm cátions e ânions que se movem livremente; compostos covalentes líquidos ou fundidos não conduzem eletricidade porque não há íons presentes.
Exemplos de compostos ligados covalentemente
- Acetileno C2H2
- Metano CH4
- Etano C2H6
- Propano C3H8
- Butano C4H10
- Benzeno C6H6
- Tolueno C7H8
- Álcool Metílico CH3Oh
- Álcool etílico C2H5Oh
- Álcool Propílico C3H7Oh
- Éter Metílico CH3OCH3
- Éter metil etílico C2H5OCH3
- Éter etílico C2H5OC2H5
- Ácido Fórmico HCOOH
- Ácido Acético CH3COOH
- Ácido Propiônico C2H5COOH
- Ácido butírico C3H7COOH
- Dióxido de Carbono CO2
- Monóxido de Carbono CO
- N nitrogênio molecular2
- Hidrogênio molecular H2