20 Exemple de alcani
Miscellanea / / July 04, 2021
alcani sunt un fel de hidrocarburi în care un număr variabil de atomi de carbon sunt uniți între ei prin legături simple, ca un schelet și fiecare atom de carbon este legat la rândul său de atomii de hidrogen, care în cele din urmă pot fi înlocuiți cu alții atomi sau grupuri funcționale. De exemplu: cloroform, metan, octan.
formulă moleculară a alcanilor cu lanț liniar deschis este CnH2n + 2, unde C reprezintă carbon, H reprezintă hidrogen și n reprezintă numărul de atomi de carbon. Alcanii sunt hidrocarburi saturate, ceea ce înseamnă că nu au legături duble sau triple. Pentru a le denumi, utilizați sufix „-Ano” după denumirea lanțului de carbon folosind prefix corespunzător numărului de atomi de carbon (et- (2), pro- (3), but- (4), pen- (5), hex- (6), hep- (7) etc.).
Vă poate servi:
Clasificarea alcanilor
În alcani sunt de obicei recunoscuți două grupuri mari: lanț deschis (denumit și aciclic) și lanț închis (sau ciclic).
Cand compuși cu lanț deschis Nu prezintă nicio substituție a hidrogenilor care însoțesc fiecare atom de carbon, sunt numiți alcani liniari: aceștia sunt cei mai simpli alcani. Când prezintă o înlocuire a oricăruia dintre hidrogenii lor cu unul sau mai multe lanțuri de carbon, aceștia sunt numiți alcani ramificați. Cei mai comuni substituenți sunt grupările etil (CH
3CH2-) și metil (CH3-).La rândul lor, există compuși cu un singur ciclu în moleculă (monociclici) și alții cu mai mulți (policiclici). alcani ciclici pot fi homociclici (se formează cu intervenția exclusivă a atomilor de carbon) sau heterociclici (la care participă alți atomi, de exemplu, oxigen sau sulf).
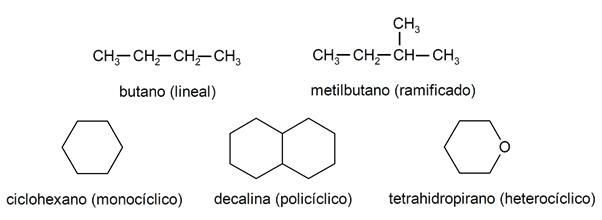
Proprietățile fizice ale alcanilor
În general, proprietăți fizice de alcani sunt condiționați de masa moleculară (la rândul lor legată de lungimea lanțului de carbon). Cei cu cel mai mic număr de atomi de carbon sunt gazos la temperatura mediu, cei variind de la 5 la 18 atomi de carbon sunt lichide, și peste acest număr sunt solid (similar cu ceara).
Fiind mai puțin dense decât apa, tind să plutească pe ea. În general, alcanii sunt insolubili în apă și solubili în solvenți organici.
Punctul de fierbere și de fuziune de alcani depinde de lor masa moleculara, adică de lungimea lanțului de carbon, deși depind și ele de multe ori de dispunerea spațială a atomilor. Alcanii liniari și ciclici au puncte de fierbere mai mari decât cele ramificate.
Proprietățile chimice ale alcanilor
Alcanii se caracterizează prin a fi compuși chimici de foarte reactivitate slabă, motiv pentru care sunt cunoscute și ca „parafine” (în latină, parum affinis înseamnă „afinitate scăzută”). Sunt compuși care au o energie de activare foarte mare atunci când sunt implicați reacții chimice. Cea mai importantă reacție pe care o pot suferi alcanii este combustie generând, în prezența oxigenului, căldurii, dioxidului de carbon și a apei.
Alcanii stau la baza unei varietăți importante de reacții asociate procese industriale foarte important, fiind cei mai tradiționali combustibili. Ele apar, de asemenea, ca produse finale ale proceselor biologice, cum ar fi fermentația metanogenă efectuată de unii microorganisme.
Exemple de alcani
Câteva exemple de alcani (inclusiv unele binecunoscute liniare și ramificate) sunt:
- Cloroform (numele de lux al fișierului triclorometan; CHCI3). Vaporii acestei substanțe se foloseau ca anestezice. Acesta a fost întrerupt în acest scop, deoarece s-a constatat că dăunează organe importante, cum ar fi ficatul sau rinichii. Utilizarea sa astăzi este în primul rând ca solvent sau agent de răcire.
- Metan (CH4). Este cel mai simplu alcan dintre toate: este alcătuit dintr-un singur atom de carbon și patru atomi de hidrogen. Este un gaz care apare în mod natural prin descompunerea diferitelor substraturi organice și este componenta principală a gazului natural. În ultima perioadă a fost recunoscut ca unul dintre gazele care contribuie cel mai mult la așa-numitul efect de seră.
- Octan (C8H18). Este alcanul cu opt carbon și are o mare importanță, deoarece determină calitatea finală a naftei, care este o amesteca a diverselor hidrocarburi. Această calitate se măsoară prin numărul octanic sau numărul octanic al combustibilului, care ia ca referință unul cu detonare redusă (index 100) și unul foarte detonant (index 0).
- Hexane (C6H14). Este un solvent important, inhalarea acestuia trebuie evitată deoarece este foarte toxică.
- Butan (C4H10). Alături de propan (C3H8), alcătuiesc așa-numitele gaze lichefiate din petrol (GPL), care se formează în pungi de gaz în timpul procesului de extracție a petrolului. În prezent, înlocuirea benzinei sau motorinei cu GPL ca combustibil este promovată încă din acest moment a unei hidrocarburi mai ecologice (emite numai dioxid de carbon și apă în timpul arderii sale).
- Icosano (C20H42). Este alcanul cu douăzeci de carbon (prefixul „ico” înseamnă douăzeci)
- Ciclopropan (C3H6). În trecut era folosit ca anestezic
- n-heptan (C7H16). Este cel care este luat ca referință pentru punctul zero al scării octanice pe benzină, care ar fi cel mai puțin de dorit, deoarece arde exploziv. Se obține din rășina anumitor plante.
- 3-etil-2,3-dimetilpentan (C9H20)
- 2-metilbutan (C5H12)
- 3-clor-4-n-propilheptan (C10H21Cl)
- 3,4,6-trimetilheptan (C10H22)
- 1-brom-2-feniletan (C8H9Br)
- 3-etil-4-metilhexan (C9H18)
- 5-izopropil-3-metilnonan (C13H28)
- cubanez (C8H8)
- 1-bromopropan (C3H7Br)
- 3-metil-5-n-propiloctan (C12H26)
- 5-n-butil-4,7-dietildecan (C18H28)
- 3,3-dimetildecan (C12H26)



