Exemplul legii lui Boyle
Fizică / / July 04, 2021
Când se studiază proprietățile gazelor, Robert Boyle, pe de o parte, și Edme mariottePe de altă parte, fără să cunoască sau să cunoască experimentele lor, au observat că gazele pot fi comprimate și că volumul lor variază proporțional cu presiunea la care sunt supuse.
Pentru a înțelege cercetările sale, trebuie să ținem cont de faptul că există trei caracteristici de luat în considerare în acest studiu al gazelor: temperatura, volumul și presiunea.
Temperatura: este temperatura la care se găsește un gaz în condițiile experimentului. Poate fi exprimat în grade Celsius (° C) sau în grade Kelvin sau zero absolut (° K). În cazul legii lui Boyle, se consideră că temperatura nu variază, adică rămâne constantă.
Volum: este spațiul pe care îl ocupă un gaz într-un container închis. În prima intenție, volumul unui gaz este volumul containerului. Pentru reprezentarea sa, se consideră că recipientul este închis și cu un piston, cum ar fi o seringă.
Presiune: Este presiunea pe care gazul o are prin piston. Într-un recipient închis, pe care pistonul este așezat ca un capac, fără a aplica presiune, se consideră că se află la presiunea atmosferică (1 at).
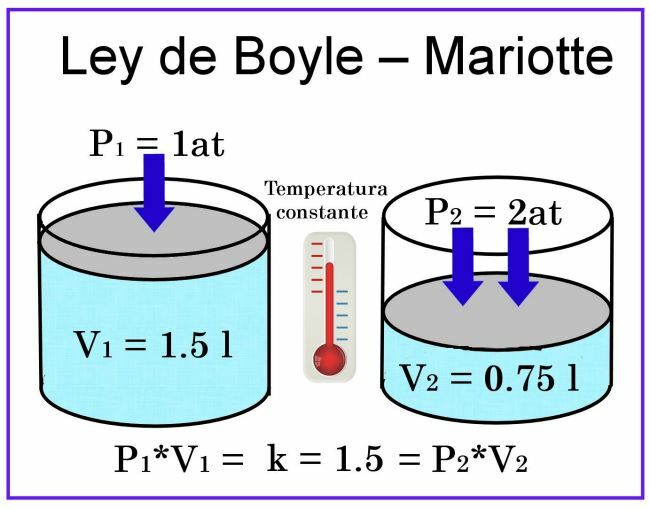
În observațiile Boyle și Mariotte, temperatura este considerată constantă, deci nu va afecta măsurarea.
În ceea ce privește volumul, dacă luăm în considerare, de exemplu, un recipient cilindric cu o capacitate de 1 litru, iar capacul său este un piston glisând, atunci când îl așezați acoperind recipientul umplut cu aer, presiunea va fi de 1 la, în timp ce volumul va fi 1 litru. Dacă asupra pistonului se exercită o presiune de 2 atmosfere, volumul gazului va fi redus la jumătate, adică la 0,5 litri sau 500 ml. Dacă presiunea crește la 4 atmosfere, volumul va fi redus la un sfert, adică la 0,25 litri sau 250 ml.
Pe baza acestor observații, apelul a fost enunțat Legea lui Boyle: La temperatură constantă, volumul unui gaz este invers proporțional cu presiunea exercitată asupra acestuia.
Aceasta înseamnă că, atunci când presiunea crește, volumul scade, iar când presiunea scade, volumul crește.
Acest lucru duce la stabilirea faptului că există o relație între presiunea unui gaz și volumul acestuia, care prin variație una dintre componente, cealaltă variază în aceeași proporție, relația rămânând constantă, adică Spune:
P * V = k
P = Presiune
V = Volum
k = constanta relației presiune-volum
Pentru a înțelege acest lucru, să presupunem că avem un recipient de 2,5 litri, care este umplut cu aer și presiunea pe piston-capac este de 1,5 la. Deci, constanta relației tale este:
P * V = k = (2,5) (1,5) = 3,75
Dacă acum creștem presiunea la 3 atmosfere, împărțim k la presiunea P și vom avea:
k / P = V
3,75 / 3 = 1,25 litri
După cum vedem, atunci când se aplică presiunea dublă, volumul este la jumătate din original și se menține constantă relația presiune-volum. Aceasta se exprimă după cum urmează:
V1P1 = V2P2 = k
Adică, produsul volumului de 1 ori presiunea 1 este egal cu produsul volumului de 2 ori presiunea 2 și această relație rămâne constantă.
Exemple de lege Boyle-Mariotte
Exemplul 1. Calculați volumul pe care îl va ocupa un gaz, care ocupă un volum de 3,75 litri, la o presiune de 2 la dacă i se aplică o presiune de 3,5 la.
V1 = 3,75 l
P1 = 2 la
V2 = ?
P2 = 3,5 la
Precum V1P1 = V2P2 = k
Calculăm constanta sistemului:
V1P1= k = (3,75) (2) = 7,5
Rezolvăm pentru V2:
V2 = k / P2 = 7,5 / 3,5 = 2.143 litri
Exemplul 2. Calculați presiunea aplicată unui gaz, dacă acesta ocupă un volum de 2,25 litri, dacă la o presiune de 1,75 are un volum de 3,25 litri.
V1 = 3,25 l
P1 = 1,75 la
V2 = 2,25 l
P2 = ?
Calculăm constanta sistemului:
V1P1= k = (3,25) (1,75) = 5,6875
Rezolvăm pentru P2:
P2 = k / V2 = 5,6875 / 2,25 = 2,53 la
Exemplul 3. Calculați presiunea inițială a unui gaz, dacă atunci când aplicați o presiune de 4,5 la, acesta ocupă un volum de 1,4 litri, iar volumul său inițial era de 2,2 litri.
V1 = 2,2 l
P1 = ?
V2 = 1,4 l
P2 = 4,5 la
Calculăm constanta sistemului:
V2P2= k = (1,4) (4,5) = 6,3
Rezolvăm pentru P2:
P1 = k / V1 = 6,3 / 2,2 = 2,863 la

