Пример Чарльза Лоу
Физика / / November 13, 2021
Газовый закон Чарльза или Закон постоянного давления - еще один газовый закон, провозглашенный Гей-Люссаком, который сделал известные работы Жака Шарля, опубликовал около 20 лет назад.
Закон Чарльза предсказывает поведение массы газа, когда давление остается постоянным, а температура и объем меняются.
Закон Чарльза сформулирован следующим образом:
При постоянном давлении объем газа прямо пропорционален изменению его температуры.
Постоянное давление: это относится к тому факту, что давление, которое газ оказывает на стенки контейнера, не будет меняться на протяжении всего опыта.
Объем: это занимаемое пространство, которое занимает газ, обычно считается контейнером со стенками, которые не деформируются, и крышка которого работает как плунжер.
Температура: Это увеличение или потеря тепла, которому подвергается газ во время экспериментов. При повышении температуры объем увеличивается. При понижении температуры уменьшается и объем.
Алгебраически закон Чарльза выражается следующей формулой:

Где:
V = объем газа
T = температура газа
k = коэффициент пропорциональности для этой массы газа.
Это означает, что для данной массы газа при постоянном давлении соотношение между объемом и изменения температуры, всегда будут иметь одинаковое соотношение пропорциональности, представленное постоянной k:

Итак, как только константа определена, мы можем вычислить любые другие значения из других известных данных:
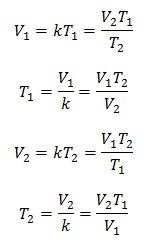
3 примера применения закона Чарльза к проблемам:
Пример 1: Рассчитайте новый объем, если в баллоне находится масса газа, которая занимает объем 1,3 литра, при температуре 280 К. Рассчитайте объем при достижении температуры 303 К.
V1 = 1,3 л.
Т1 = 280 К
V2 = ?
Т2 = 303 К
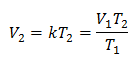
Подстановка значений:
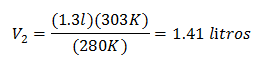
Новый объем у 303 К составляет 1,41 литра.
Пример 2. Если у нас есть газ, который занимает 2,4 литра при 10 градусах Цельсия, рассчитайте конечную температуру, если он занимает 2,15 литра после завершения.
V1 = 2,4 л
Т1 = 10 ° С = 283 К
V2 = 2,15 л
Т2 = ?
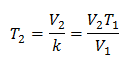
Подстановка значений:
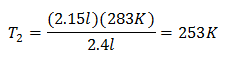
Новая температура составляет 253 К, что равно -20 ° С.
Пример 3. У нас есть газ, для которого мы знаем, что его начальная температура составляет 328 К, его конечный объем составляет 3,75 л, а его константа соотношения составляет 0,00885.
V1 = ?
Т1 = 328 К
V2 = 3,75 л
Т2 = ?
к = 0,00885
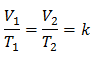
Подстановка значений:
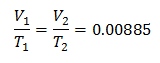
Чтобы узнать начальный объем:
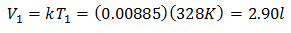
Начальный объем 2,90 л.
Чтобы узнать конечную температуру:
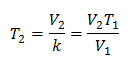
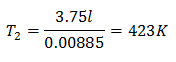
Конечная температура составит 423 К, что равно 150 ° С.


