Пример пептидной связи
Химия / / July 04, 2021
В Пептидная связь тот, в котором две молекулы аминокислот соединяются путем конденсации.
Чтобы лучше понять пептидные связи, сначала необходимо определить аминокислоты:
В Аминокислоты - это органические молекулы короткий, содержащий как минимум аминогруппа (-NH2)щелочная по природе, и карбоксильная группа (-COOH)кислый характер.
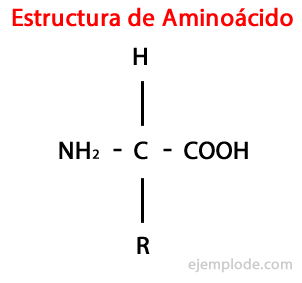
Хотя живые существа синтезируют для разных целей очень разные типы аминокислот, наиболее важными из них являются те, которые входят в состав белков, все они принадлежат к классу α-аминокислоты.
Α-аминокислоты характеризуются тем, что кислотные и аминогруппы присоединены к одному и тому же атому углерода, называемому α углеродом. Кроме того, этот α-углерод связывает в качестве третьего заместителя с атомом водорода и в качестве четвертого заместителя заместитель, дополнительная группа различного размера и характеристик, которая отличает каждую аминокислоту от другие.
Четвертый заместитель называется Боковая цепь аминокислоты и часто в упрощенном виде обозначается буквой R.
Поскольку четыре заместителя α-углерода различны и имеют тетраэдрическое расположение вокруг него, присутствующие α-аминокислоты оптическая изомерия, когда молекула имеет альтернативная форма это похоже на зеркальное отражение его, который, в конце концов, не является равной молекулой. Эти две изомерные формы молекулы обозначаются буквами D или L, в зависимости от того, как заместители расположены в пространстве. Все аминокислоты, входящие в состав белков, относятся к L.
Аминокислоты классифицируются в соответствии с их химическим характером в Полярный и аполярный. Полярники в свою очередь делятся на Нейтральный и заряженный (который может быть кислотным или основным). В Неполярные могут быть алифатическими или ароматическими.
Пептиды и пептидная связь
Пептиды являются продуктом ковалентного объединения аминокислот через амидные связи, образующегося за счет конденсация карбоксильного конца одного и амино-конца другого с высвобождением молекулы воды в реакция. Этот союз называется Peptide Bond.
Механизм этой реакции представлен ниже, в котором Амино- и карбоксильные группы, и происходит конденсация молекул аминокислот с образованием пептида.
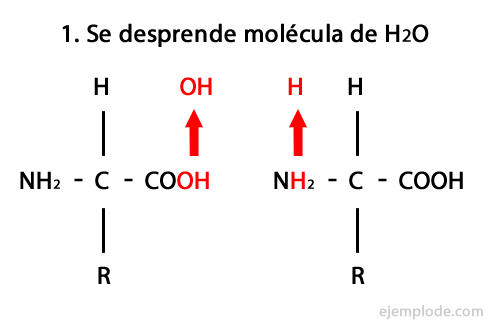
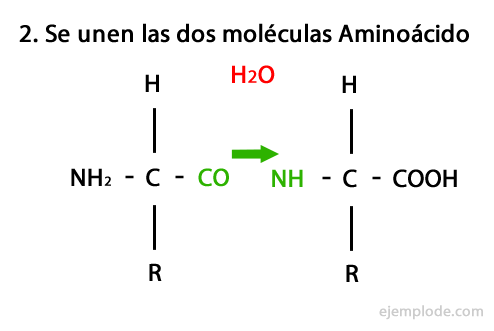

Пептиды, такие как аминокислоты и белки, имеют на концах аминогруппу и карбоксильную группу не реагируя.
Чтобы указать формулу простого пептида и даже белка, достаточно перечислить входящие в его состав аминокислоты, начиная с той, у которой есть бесплатная аминогруппа, и заканчивая тем, у которого есть свободная карбоксильная группа.
Некоторые пептиды, обнаруженные в организме, являются Вазопрессин, который повышает артериальное давление и увеличивает реабсорбцию воды в почках; в Энкефалин, что снижает болевые ощущения; и Окситоцин, что заставляет матку сокращаться.
Характеристики пептидной связи
Конденсация аминогруппы одной аминокислоты с карбоксилом другой, проходит в водном растворителе, чтобы это не спонтанно, поэтому для синтеза белка требуется запас энергии.
Пептидная связь, как и любая амидная связь, представляет собой резонанс между двумя крайними формами: нейтральная форма, с одинарной связью, соединяющей карбонильный углерод первой аминокислоты и аминный азот второй (C-N), и бланк с разделением зарядов в котором два атома связаны двойной связью (C = N). В действительности пептидная связь не допускает ни одной из двух крайних ситуаций, но представляет собой резонансный гибрид обоих.
Есть звонок Пептидный самолет, состоящий из все атомы, участвующие в пептидной связи, которые присоединяются к двум исходным аминокислотам. С одной стороны, атомы азота и водорода с их соответствующим углеродом α в первой аминокислоте. С другой стороны, углерод α другой аминокислоты с кислородом и углеродом карбонильной группы.
Различия между пептидами и белками
В пептиды имеют низкое количество аминокислот, которых насчитывается от двух до нескольких десятков, и их конформация в растворе становится гибкой.
В маленькие белки, структурно близкие к крупным пептидам, имеют определенное телосложение и гораздо менее гибкое.
Есть белки, которые, как и пептиды, имеют неупорядоченную и гибкую конформацию, но в том же порядке, когда они взаимодействуют с другими макромолекулами в клетке.
20 примеров аминокислот, участвующих в связывании пептидов
- Глициния
- Девушке
- Валин
- Лейцин
- Изолейцин
- Пролин
- Метионин
- Фенилаланин
- Тирозин
- Триптофан
- Серин
- Треонин
- Цистеин
- Аспарагин
- Глутамин
- Аспарагиновая кислота
- Глютаминовая кислота
- Лизин
- Аргинин
- Гистидин



