20 Príklady solí s kyselinami
Rôzne / / July 04, 2021
V anorganická chémia soli sa nazývajú zlúčeniny, ktoré sa získavajú, keď a kyselina jeho atómy vodíka sú nahradené kovovými katiónmi (aj keď niekedy nekovovými katiónmi, napríklad amónnym katiónom, NH4+). V konkrétnom prípade kyslé soli, vodíky kyseliny sú čiastočne substituované, to znamená, že ako súčasť soli zostáva najmenej jeden nesubstituovaný vodík. V tom, že sa odlišujú od neutrálne soli, kde sú vodíky kyseliny úplne substituované.
The Choď von sa obvykle tvoria reakciou medzi a kyselina a a hydroxid (základ). Pri týchto reakciách báza normálne stráca svoje hydroxylové skupiny (-OH) a kyselina ich stráca. atómy vodík (H), tvoriaci neutrálnu soľ; ale ak príslušná kyselina zachováva najmenej jeden zo svojich atómov vodíka a mení tak elektrický náboj reakcie, získame kyslú soľ alebo hydrogenovanú soľ.
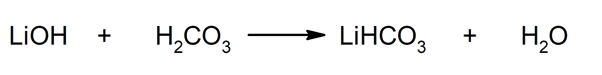
Tak sa napríklad hydrogenuhličitan lítny a voda získajú reakciou medzi hydroxidom lítnym a kyselinou uhličitou:
Názvoslovie solí kyselín
Kyselinové soli možno pomenovať podľa tri typy najbežnejšia nomenklatúra:
Príklady solí s kyselinami
- Hydrogenuhličitan sodný (NaHCO3). Tiež sa nazýva hydrogenuhličitan sodný (IV), je to biela kryštalická pevná látka rozpustná vo vode, ktorú je možné nájsť v prírode v stave minerál alebo sa dá vyrobiť v laboratóriu. Je to jedna z najznámejších solí s kyselinami a široko sa používa v cukrovinkách, farmakológii alebo pri výrobe jogurtov.
- Hydrogenuhličitan lítny (LiHCO3). Táto kyslá soľ sa použila ako zachytávacie činidlo pre CO2 v situáciách, keď je takýto plyn nežiaduci, ako napríklad v severoamerických vesmírnych misiách „Apollo“.
- Dihydrogenfosforečnan draselný (KH2PO4). Je to kryštalická pevná látka, bez zápachu, rozpustná vo vode, široko používaná v rôznych priemyselných odvetviach, napríklad v droždí jedlo, chelatačné činidlo, výživný posilňovač a pomocník vo fermentačných procesoch.
- Hydrogénsíran sodný (NaHSO4). Je to kyslá soľ, ktorá vzniká neutralizáciou kyseliny sírovej. Je priemyselne široko používaný pri rafinácii kovov a čistiacich prostriedkov. Aj keď je vysoko toxický pre niektoré ostnokožce, používa sa ako prísada do krmiva pre domáce zvieratá a na výrobu šperkov.
- Sírovodík sodný (NaHS). Je to nebezpečná zlúčenina, s ktorou sa manipuluje, pretože je vysoko korozívna a toxická. Môže to spôsobiť vážne popáleniny kože a poškodenie očí, pretože je tiež horľavý.
- Hydrogénfosforečnan vápenatý (CaHPO4). Používa sa ako doplnok výživy v obilniny pre dobytok. Je to pevná látka nerozpustná vo vode, ktorá je však po hydratácii schopná kryštalizovať pri konzumácii dvoch molekuly z vody.
- Hydrogenuhličitan amónny ([NH4] HCO3). Tiež známy ako „hydrogenuhličitan amónny“ sa používa v potravinárskom priemysle ako kvasnice chemická látka, aj keď má tú nevýhodu, že zachytáva amoniak a dodáva jedlám zlú chuť, ak sa používa v prebytok. Používa sa tiež v hasiacich prístrojoch, pri výrobe pigmentov a na expandovanie gumy.
- Hydrogenuhličitan barialebo (Ba [HCO3]2). Je to kyslá soľ, ktorá po zahriatí môže zvrátiť svoju produkčnú reakciu a je vysoko nestabilná, s výnimkou roztoku. Je široko používaný v keramickom priemysle.
- Hydrogénsiričitan sodný (NaHSO3). Táto soľ je mimoriadne nestabilná a za prítomnosti kyslíka sa odvodzuje do síranu sodného (Na2SW4), a preto sa používa v potravinárskom priemysle ako konzervačný prostriedok a desikant. Je to extrémne redukčný prostriedok a človekom bežne používaný, používaný aj na fixáciu farieb.
- Citrát vápenatý (AC3[C.6H5ALEBO7]2). Bežne známa ako horká soľ, používa sa ako konzervant potravín a ako doplnok výživy, keď je spojená s aminokyselinou lyzínom. Je to biely kryštalický prášok bez zápachu.
- Monofosforečnan vápenatý (Ca [H2PO4]2). Je to bezfarebná pevná látka, ktorá sa získava reakciou hydroxidu vápenatého a kyseliny fosforečnej, široko používaná ako kypriaci prostriedok alebo ako hnojivo v poľnohospodárskych prácach.
- Fosforečnan vápenatý (CaHPO4). Tiež známy ako monohydrogenfosforečnan vápenatý, má tri rôzne kryštalické formy, ktoré sa používajú ako prísada do potravín, a je prítomný v zubných pastách. Okrem toho sa prirodzene vytvára v obličkových kameňoch a v takzvanom „obličkovom kameni“.
- Monomagnézium fosfát (MgH4P2ALEBO8). Je to biela kryštalická soľ bez zápachu, čiastočne rozpustná vo vode. Používa sa na konzerváciu potravín, ako okysľovadlo, ako korektor kyslosti alebo látka pri liečbe múky.
- Diacetát sodný (NaH [C.2H3ALEBO2]2). Táto soľ sa používa ako ochucovadlo a konzervačná látka v jedlách, ktorá zabraňuje alebo oneskoruje vzhľad huby a mykobaktérie, a to ako vo vákuovo balených výrobkoch, ako sú mäsové výrobky, tak aj v múčnom priemysle.
- Hydrogenuhličitan vápenatý (Ca [HCO3]2). Je to hydrogenovaná soľ, ktorá pochádza z uhličitanu vápenatého a nachádza sa v mineráloch, ako sú vápenec, mramor a ďalšie. Táto reakcia zahrnuje prítomnosť vody a CO2, takže sa môže vyskytnúť spontánne v jaskyniach a jaskyniach bohatých na vápnik.
- Fluorid kyseliny rubídnej (RbHF). Táto soľ sa získava reakciou kyseliny fluorovodíkovej (vodík a fluór) a rubídia, alkalického kovu. Výsledkom je toxická a korozívna zlúčenina, s ktorou sa musí zaobchádzať opatrne.
- Fosforečnan amónny ([NH4] H2PO4). Je to vo vode rozpustná soľ vyrobená reakciou amoniaku a kyseliny fosforečnej. Zvyčajne sa používa ako hnojivo, pretože dodáva pôde pôdu živiny dusíka a fosforu nevyhnutných pre rast rastlín. Je tiež súčasťou prášku ABC v hasiacich prístrojoch.
- Hydrogén ortoboritan zinočnatý (Zn [HBO3]). Je to soľ používaná ako antiseptikum a ako prísada pri výrobe keramiky.
- Fosforečnan sodný (NaH2PO4). Používa sa väčšinou v laboratóriách ako „pufer“ alebo tlmivý roztok, ktorý zabraňuje náhlym zmenám pH roztoku.
- Hydrogenftalát draselný (KHP). Tiež sa nazýva „ftalát kyseliny draselnej“, je to pevná a stabilná soľ v obyčajnom vzduchu, preto sa často používa ako primárny štandard pri meraniach pH. Je to tiež užitočné ako tlmivý prostriedok v chemické reakcie.
Postupujte podľa:


