Príklad organických a anorganických molekúl
Chémia / / November 13, 2021
The Všeobecná chémia je to veda, ktorá študuje všetky druhy hmoty, ktoré existujú, a jeho vnútorné zmeny mať kontakt medzi rôznymi typmi tohto.
The Organická chémia Je to časť všeobecnej chémie určená na štúdium látky, ktorej hlavnou zložkou je Uhlíkový prvok, No a čo je súčasťou živých organizmov.
The Anorganická chémia Práve časť Všeobecnej chémie má na starosti štúdium tzv "minerálna látka", ktorý je súčasťou Nežijem prostredím.
The Molekula je spojenie rôzne atómy rôznych prvkov chemických látok na vytvorenie nových látok s ich osobitnými vlastnosťami.
Vo všeobecnej chémii Prvky Sú čisté látky ktoré sú tvorené atómy jedného typu. Prvky sú klasifikované v periodickej tabuľke chemických prvkov.
Presne ako on Atóm je základná jednotka prvkov, Molekula je hlavnou jednotkou zlúčenín, čo sú látky, ktoré majú charakteristické chemické správanie.
The zlúčeniny môže vzniknúť ako dôsledok prirodzený fenomén, alebo byť vytvorené v laboratóriách alebo v Priemyselné závody, takže molekuly sú prítomné všade. Molekuly sa nachádzajú v mineráloch, v listoch stromov, v potravinách, v liekoch, vo vode, ktorú pijeme, vo vzduchu, ktorý dýchame, a dokonca aj v znečistení životného prostredia.
Všeobecná chémia sa delí hlavne na Anorganická chémia a Chemickýdo Orgnica, takže molekuly môžu byť tiež rozdelené na anorganické a organické.
Anorganické molekuly
V anorganickej chémii sú molekuly väčšinou tvorené kombinácia atómov pozitívnych valencií s inými negatívnymi valenciami v iónových väzbách. Tieto väzby sú tvorené hlavne elektromagnetickými silami medzi atómami, generovanými prítomnosťou valenčných elektrónov.
Tak vznikajú všetky iónové zlúčeniny, ako sú soli, oxysoli, kyseliny, oxykyseliny, oxidy a hydroxidy.
Anorganické molekuly ako elektrolyty
Hlavnou vlastnosťou iónových molekúl je, že keď prídu do kontaktu s vodou H2ALEBO, sú rozdelené na dve časti: pozitívnu a negatívnu. Tieto dve časti, elektricky nabité atómy alebo skupiny atómov, sú rozptýlené vo vode. K anorganickej látke schopnej sa takto oddeliť vo vode, nazýva sa to Elektrolyt.
Roztok tvorený vodou a kladne a záporne nabitými časticami sa nazýva "Elektrolytický roztok". Tento typ roztoku má schopnosť viesť elektrické prúdy, a preto sa používa v elektrochemických článkoch, ako sú napríklad autobatérie.
Anorganické kyseliny a alkalické molekuly
V prípade anorganických molekúl ako napr Kyseliny, Oxykyseliny a Hydroxidy, zároveň s tým, že sa rozdeľujú na kladnú a zápornú časť, prispievajú k riešeniu vlastnosťou nazývanou vodíkový potenciál, meranú ako záporný logaritmus koncentrácie vodíkových iónov.
The Vodíkový potenciál (pH) určuje, nakoľko je roztok kyslý. Na stupnici pH, ktorá siaha od hodnoty 1 pre maximálnu kyslosť po 14, čo je úplná zásaditosť alebo zásaditosť, kyslý charakter sa pohybuje od hodnôt 1 do 6 a zásaditosť je medzi 8 a 14. 7 predstavuje neutrálne pH; ani kyslé, ani zásadité. Výsledok záporného logaritmu koncentrácie H + nám povie, kde sa na stupnici nachádzame.
Príklady kyselín:
Kyselina chlorovodíková: HCl: H+ + Cl-
Kyselina bromovodíková: HBr: H+ + Br-
Kyselina sírová: H2S: 2H+ + S-2
Kyselina kyanovodíková: HCN: H+ + KN-
Kyselina chlorovodíková: HI: H+ + ja-
Príklady oxykyselín:
Kyselina sírová: H2SW4: 2H+ + SO4-2
Kyselina uhličitá: H2CO3: 2H+ + CO3-2
Kyselina dusičná: HNO3: H+ + NIE3-
Kyselina fosforečná: H3PO4: 3H+ + PO4-3
Kyselina chloristá: HClO4: H+ + ClO4-
Príklady hydroxidov:
Hydroxid sodný: NaOH: Na+ + OH-
Hydroxid vápenatý: Ca (OH)2: Ca+ + 2OH-
Hydroxid amónny: NH4OH: NH4+ + OH-
Hydroxid draselný: KOH: K+ + OH-
Hydroxid horečnatý: Mg (OH)2: Mg+ + 2OH-
Anorganické molekuly v chemických reakciách
Keď sa anorganické molekuly zúčastňujú chemickej reakcie, existujú štyri základné a jednoduché reakčné mechanizmy: Syntéza, rozklad, jednoduchá substitúcia a dvojitá substitúcia. Tu je príklad každého z nich:
Syntéza
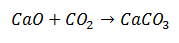
Syntetická reakcia je taká, pri ktorej dve molekuly sa spoja v konečnom produkte pozostávajúcom z jednej molekuly. V príklade ide o prípad, keď sa oxid vápenatý kombinuje s oxidom uhličitým za vzniku molekuly uhličitanu vápenatého.
rozklad:

Rozkladná reakcia je taká, pri ktorej počiatočná molekula sa rozdelí na dve nové stabilné molekuly. To je prípad hydroxidu vápenatého, ktorý sa delí na molekulu oxidu vápenatého a ďalšiu molekulu vody.
Jednoduchá náhrada:

V jednoduchej substitučnej reakcii atóm prvku sa vymení za jeden z atómov molekuly. To je prípad kovového zinku, ktorý sa umiestňuje na miesto vodíka v chlorovodíku, uvoľňuje ho a vytvára molekuly chloridu zinočnatého.
Dvojité striedanie:
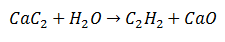
Pri dvojitej substitučnej reakcii určité atómy dvoch počiatočných molekúl sa vymenia, aby sa vytvorili dve rôzne molekuly ako produkty. To je prípad karbidu vápenatého, ktorý podlieha uvoľňovaniu uhlíka, ktorý sa spojí s vodíkom z vody za vzniku acetylénu. Vápnik sa bude viazať na kyslík za vzniku oxidu vápenatého ako druhého produktu.
Organické molekuly
Organická chémia je chémia uhlíka, čo znamená, že všetky organické molekuly budú obsahovať tento prvok v rôznych štruktúrnych usporiadaniach.
Organické molekuly sa vyznačujú konštantná prítomnosť kovalentných väzieb. Kovalentné väzby s tými, v ktorých dva atómy sa spoja, aby zdieľali svoje valenčné elektróny a tak vzájomne dopĺňali svoje oktety.
To je prípad uhlíka, ktorý sa viaže na iné atómy toho istého prvku. Vznikajú reťazce veľmi rôznych dĺžok, od dvoch do šesťdesiatich atómov uhlíka, a dokonca aj tieto reťazce rozvetvujú sa s inými reťazcami s rovnakou rozmanitosťou dĺžok, čím sa dosahuje nesmierna rozmanitosť molekúl organické.
Prítomné sú aj iónové väzby, ktoré sa však vyskytujú v medzistupňoch dlhých reakčných mechanizmov, v ktorých vzniká požadovaná molekula.
Medzi najjednoduchšie organické molekuly patrí uhlík a vodík. Ten dopĺňa uhlíkovú valenciu, ktorá si to vyžaduje.
V organickej chémii môžu byť molekuly lineárne alebo alifatické, rozvetvené, cyklické a aromatické.
Okrem toho sú v organických molekulách zahrnuté prvky kyslík, dusík, síra a fosfor, čo vytvára pôsobivú rozmanitosť funkčných skupín pre molekuly.
Funkčné skupiny v organických molekulách
The Funkčné skupiny sú skupiny dvoch alebo viacerých atómov, ktoré po spojení uhlíkovo-vodíkového reťazca vytvárajú rôzne chemické druhy s určitým správaním.. Ďalej je uvedených sedem hlavných typov organických molekúl s ich príslušnými funkčnými skupinami. Písmeno "R" sa používa na označenie uhlíkovo-vodíkového reťazca.
Alkylhalogenidy - Forma: R-X / Funkčná skupina: A Halogénový prvok (chlór, bróm, jód)

Alkoholy - Forma: R-OH / Funkčná skupina: -OH alebo hydroxyl.
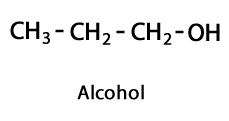
Aldehydy - Forma: R-CHO / Funkčná skupina: -CHO, ktorá ide vždy na koniec reťazca.
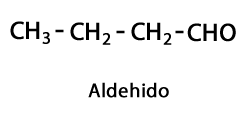
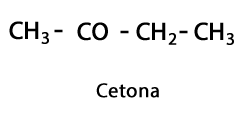
Ketóny - Forma: R-CO-R / Funkčná skupina: -CO- alebo karboxy, vždy v strede uhlíka reťazca.
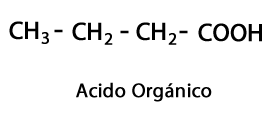
Organické kyseliny - Forma: R-COOH / Funkčná skupina: -COOH alebo karboxyl, vždy na konci reťazca.
Estery kyselín - Forma: R-COO-R / Funkčná skupina: -COO-, je výsledkom spojenia kyslého reťazca s iným uhlíkovo-vodíkovým reťazcom.
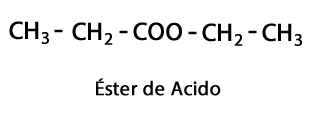
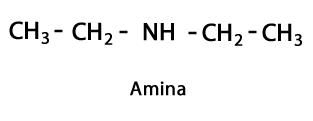
Amines - Forma: R-NH2, R-NH-R, R-N-2R / Funkčná skupina: -NH2, -NH-, -N = alebo Amino, čo je dusík doplnený vodíkom v miestach, kde nie je uhlíkovo-vodíkový reťazec. Ako je uvedené, môže ísť na koniec reťazca alebo do stredu. Atóm dusíka môže byť sprevádzaný jedným, dvoma alebo tromi organickými reťazcami za vzniku konečnej molekuly. Amíny možno považovať za organické deriváty amoniaku NH3.
Organické molekuly v chemických reakciách
Organické molekuly, čím dlhšie majú uhlíkovo-vodíkové reťazce, tým viac miest alebo atómov je dostupných na účasť v chemickej reakcii.
Najčastejšie sa prvky alebo reťazce pridávajú k jednému z prítomných uhlíkov alebo sa časť hlavného reťazca oddelí, aby sa vytvorila odlišná organická zlúčenina.
Keďže takéto reakcie sú pomalé, používajú sa katalyzátory, čo sú chemické činidlá na urýchlenie reakcií. V niektorých prípadoch je katalyzátor jemná sieť z platinového kovu.
Príklady anorganických molekúl
Chlorid sodný NaCl
Chlorid draselný KCl
Chlorid amónny NH4Cl
Dusičnan sodný NaNO3
Dusičnan draselný KNO3
Dusičnan amónny NH4NIE3
Kyselina sírová H2SW4
Kyselina fosforečná H3PO4
Kyselina fosforitá H3PO3
HCl kyselina chlorovodíková
kyselina jódovodná HI
Hydroxid sodný NaOH
Hydroxid draselný KOH
Hydroxid amónny NH4Oh
Hydroxid vápenatý Ca (OH)2
Hydroxid horečnatý Mg (OH)2
Hydroxid železnatý Fe (OH)2
Hydroxid železitý Fe (OH)3
Sulfid železa FeS
Síran železnatý FeSO4
Síran železitý Fe2(SW4)3
Príklady organických molekúl
Glukóza C6H12ALEBO6
Metán CH4
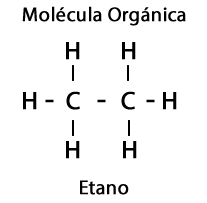
Ethane C2H6
Acetylén C2H2
Propán C3H8
Bután C4H10
Etanol C2H6ALEBO
Sacharóza C12H22ALEBO11
Metanol CH4ALEBO
Glycerol C3H8ALEBO3



