30 Príklady aldehydov
Príklady / / November 06, 2023
The aldehydy sú Organické zlúčeniny ktoré sú tvorené uhlíkovým reťazcom, ktorý má pripojenú koncovú karbonylovú skupinu (= C = O) (umiestnenú na jednom konci molekula), ktorý je zase naviazaný na atóm vodíka.
Veľmi rozšírené aldehydy sú methanal (formaldehyd), etanal (acetaldehyd) a propanal (propaldehyd).

Niektoré z týchto zlúčenín sú prítomné v prírode, napríklad vanilín alebo vanilín je prírodný aldehyd, ktorý tvorí hlavnú príchuť vanilky.
- Pozri tiež: Aldehydy a ketóny
Nomenklatúra aldehydov
Aldehydy môžu byť pomenované podľa pravidiel nomenklatúry stanovených Medzinárodnou úniou čistej a aplikovanej chémie (IUPAC).
Na pomenovanie aldehydu sa používajú predpony, ktoré označujú počet atómov uhlíka, ktoré má uhlíkový reťazec pripojený ku karbonylovej skupine. Karbonylová skupina je vždy umiestnená na jednom konci uhlíkového reťazca, čo znamená, že bude mať vždy polohu jedna a nie je potrebné uvádzať jej umiestnenie v reťazci. Navyše, prípona -al je umiestnená na konci názvu aldehydu. Niektoré príklady:
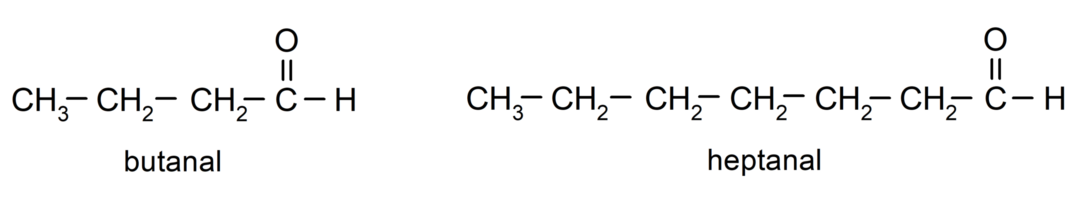
Ak je aldehyd rozvetvený, to znamená, že sa skladá z niekoľkých uhlíkových reťazcov, tzv hlavný reťazec ako reťazec, ktorý má najväčší počet atómov uhlíka a ktorý tiež obsahuje skupinu karbonyl. Zvyšné reťazce sú pomenované ako substitučné skupiny.
Ďalej, každá skupina substituentov musí byť zvolená tak, aby jej poloha zaujímala najnižšie možné číslovanie v hlavnom uhlíkovom reťazci. Na druhej strane sa atómy uhlíka hlavného reťazca začínajú počítať na konci, ktorý obsahuje karbonylovú skupinu. Niektoré príklady:
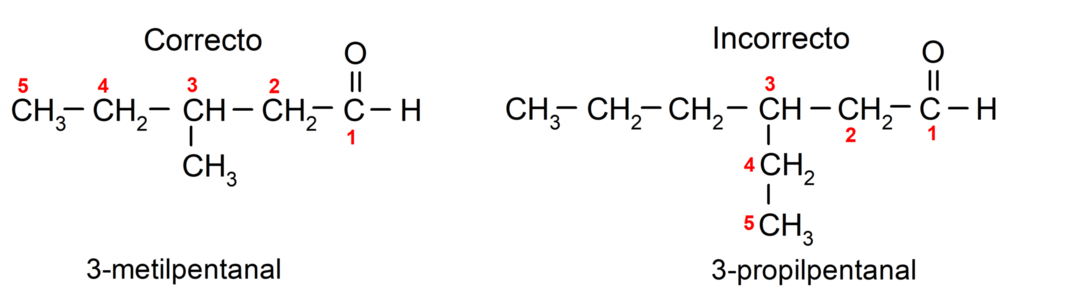
Ak aldehyd pôsobí ako substituent v molekule, pretože sa skladá aj zo skupín funkčné skupiny s vyššou prioritou, ako sú kyseliny a estery, potom je aldehydová skupina pomenovaná ako -oxo. Napríklad:

Ak má aldehyd niekoľko karbonylových skupín, pomenúva sa pomocou predpôn, ktoré označujú počet týchto skupín, dial (dve karbonylové skupiny), trial (tri karbonylové skupiny) atď. Napríklad:
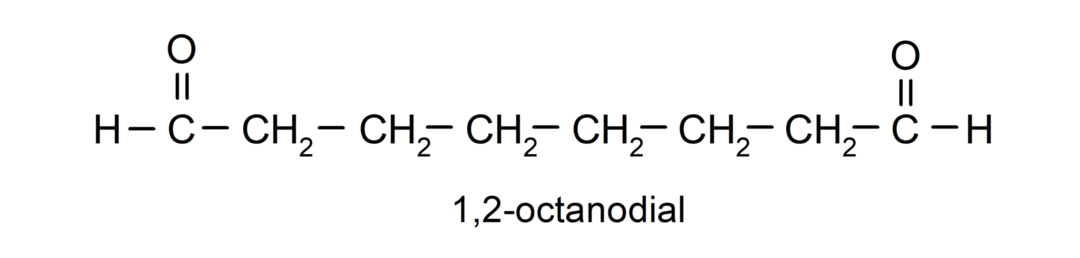
Keď je karbonylová skupina pripojená k cyklu, aldehydy sú pomenované s použitím termínu karbaldehyd. Napríklad:

Fyzikálne vlastnosti aldehydov
Aldehydy majú zvyčajne určitú variáciu rovnakých fyzikálnych vlastností. K tomu dochádza, pretože fyzikálne vlastnosti aldehydov závisia od toho, ako sa tvorí uhlíkový reťazec, ktorý je pripojený ku karbonylovej skupine.
Niektoré fyzikálne vlastnosti aldehydov sú:
- Rozpustnosť. Rozpustnosť aldehydov vo vode závisí od množstva atómov ktorý má uhlíkový reťazec. Aldehydy s kratšími uhlíkovými reťazcami (do približne piatich atómov uhlíka) sú rozpustné vo vode. Aldehydy s uhlíkovými reťazcami s mnohými atómami uhlíka nie sú rozpustné vo vode. Metán a etanol sú veľmi dobre rozpustné vo vode.
- Hustota. Vo všeobecnosti sú aldehydy zlúčeniny, ktoré sú menej husté ako voda.
- agregačné štáty. Aldehydy sa skladajú z jedného a dvoch atómov uhlíka plynovsú tie, ktoré obsahujú tri až dvanásť atómov uhlíka kvapalinya tie, ktoré pozostávajú z viac ako dvanástich atómov uhlíka, sú pevné.
- Vôňa. Niektoré aldehydy majú dráždivý zápach, zatiaľ čo iné majú príjemný zápach.
- Polarita. Karbonylová skupina im dáva polaritu.
- Bod varu. Majú vyššie teploty varu ako alkány s podobnou molekulovou hmotnosťou a majú nižšie teploty varu ako karboxylové kyseliny a alkoholy s porovnateľnou molekulovou hmotnosťou.
Chemické vlastnosti aldehydov
Niektoré z chemických vlastností aldehydov sú:
Aldehydy sa oxidujú, keď reagujú s Tollensovým, Benediktovým a Fehlingovým činidlom. za vzniku zodpovedajúcej karboxylovej kyseliny. Vzniknutá kyselina bude mať rovnaký počet uhlíkov v uhlíkovom reťazci ako aldehyd, z ktorého vznikla. Napríklad:
- Oxidácia Tollensovým činidlom (amoniakálny komplex striebra v zásaditom roztoku, [Ag (NH3)2]+). Touto reakciou vzniká zodpovedajúca kyselina a kovové striebro.

- Oxidácia Benediktovým a Fehlingovým činidlom (alkalické roztoky síranu meďnatého (CuSO)4) s rôznym zložením). Táto reakcia produkuje zodpovedajúcu kyselinu a oxid meďný (Cu2BUĎ).

Podstupujú nukleofilné adičné reakcie, kde sa ku karbonylovej skupine aldehydov pridávajú nukleofily. Niektoré príklady:
- adičné reakcie alkoholy na karbonylovú skupinu aldehydov za vzniku acetálov a poloacetálov.
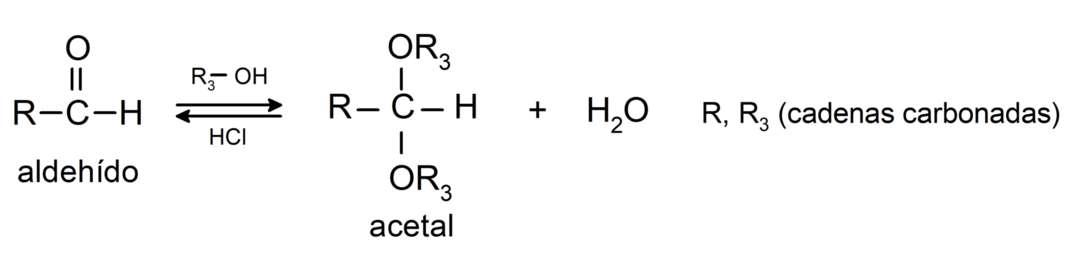
- adičné reakcie amíny primárne ku karbonylovej skupine.

- Adičné reakcie s kyselinou kyanovodíkovou (HCN), pri ktorých vznikajú kyanohydríny alebo kyanohydríny.

Podstupujú aldolové kondenzačné reakcie. Pri tomto type reakcie kondenzujú dva aldehydy za vzniku aldolu. Sú to reakcie, ktoré sa vyskytujú s hydroxidom sodným (NaOH). Napríklad:
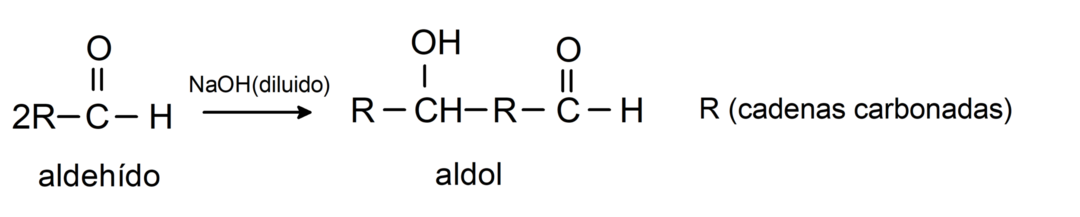
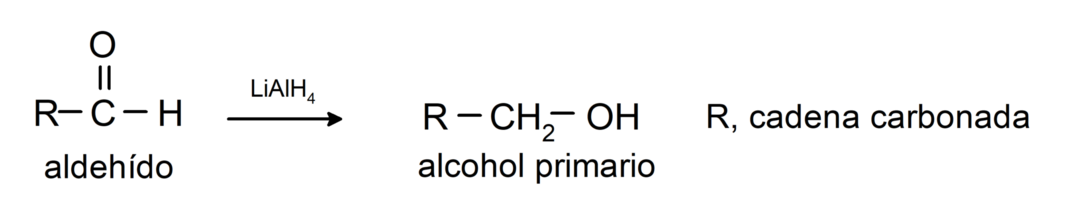
Podstupujú redukčné reakcie na primárne alkoholy. V prítomnosti borohydridu sodného (NaBH4) a lítiumalumíniumhydridu (LiAlH4) alebo katalytickou hydrogenáciou sa redukujú na primárne alkoholy. Napríklad:
Príklady aldehydov
- metán (formaldehyd)
- etanol (acetaldehyd)
- propanal (propaldehyd)
- butanal
- pentanal
- vanilín
- cinnamaldehyd
- propenal
- benzaldehyd
- hexanal
- 3-brómcyklopentánkarbaldehyd
- cyklohexánkarbaldehyd
- 4,4-dimetylpentanal
- 2-hydroxybutanal
- 2-hydroxy-2-metylbutanal
- 2,3-dimetylpentanal
- pentanedial
- cyklopentánkarbaldehyd
- izobutanal
- 2-chlórbutanal

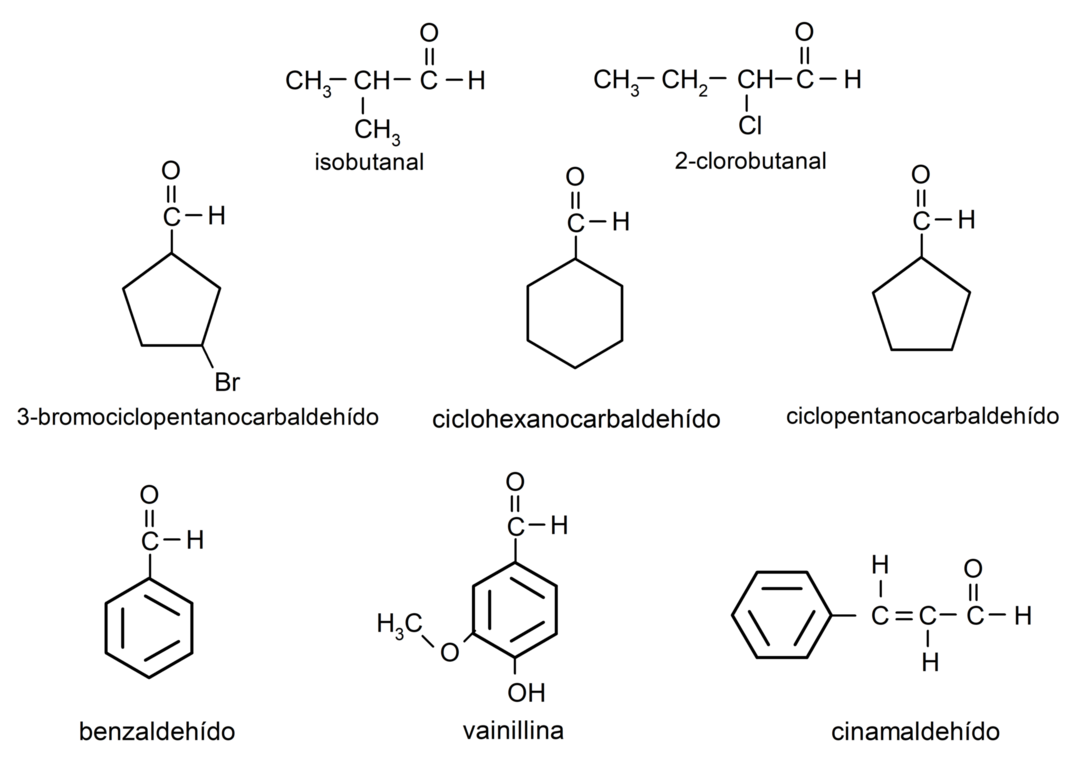
Aldehydy v prírode
Niektoré aldehydy prítomné v prírode sú:
- Benzaldehyd, súčasť mandlí.
- Cinnamaldehyd, zložka, ktorá dodáva škoricovej esencii jej vôňu.
- Vanilín, zložka, ktorá dodáva vanilke jej chuť.
Na druhej strane jedna z foriem glukózy, otvorená forma, má aldehydovú funkčnú skupinu.
Predpokladá sa, že acetaldehyd, ktorý vzniká ako medziprodukt pri metabolizácii alkoholu, spôsobuje pri intoxikácii alkoholom symptómy kocoviny.
Použitie aldehydov
Niektoré z hlavných použití aldehydov sú:
- Používajú sa pri výrobe rozpúšťadiel, farieb, kozmetických produktov a esencií.
- Používajú sa pri výrobe živíc. Bakelit sa vyrába s formaldehydom a je to živica, ktorá veľmi dobre funguje ako elektrický izolant.
- Používali sa ako sedatíva. Paraldehyd sa používal ako sedatívum a hypnotikum, aj keď sa v súčasnosti pre jeho nepríjemný zápach nepoužíva.
- Používajú sa ako konzervačné látky pre biologické vzorky a mŕtvoly. Formaldehyd je v tomto zmysle široko používaný.
- Používajú sa ako príchute potravín. Príkladom je vanilín, ktorý dáva dezertom vanilkovú arómu.
- Používajú sa ako dezinfekčné prostriedky.
Nebezpečenstvo aldehydov
Viaceré aldehydy boli považované za karcinogénne, napríklad formaldehyd bol podľa WHO (Svetovej zdravotníckej organizácie) vyhlásený za karcinogénnu zlúčeninu.
Expozícia a kontakt s mnohými aldehydmi spôsobuje podráždenie pokožky, očí a dýchacích ciest. Na druhej strane spôsobuje kontaktnú dermatitídu a ochorenia pečene.
Referencie
- Solomons, T.W. Graham a María Cristina Sangines Franchini (1985). “organická chémia“ Mexiko, D.F.: Limusa.
- Whitten, K. W., Gailey, K. D., Davis, R. E., de Sandoval, M. T. TO. O. a Muradás, R. M. g. (1992). “Všeobecná chémia" (str. 108-117). McGraw-Hill.
- Arteaga, P. M. (2017). “Ketóny a aldehydy” Vedecký bulletin Svedomia prípravnej školy číslo 3, 4(8).
Nasledujte s:
- Cukry
- Hydracidy
- Etylalkohol
- Organické a anorganické zlúčeniny


